よむ、つかう、まなぶ。
【資料1】医薬品の製造方法等に係る薬事審査等のあり方について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35743.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第4回 10/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
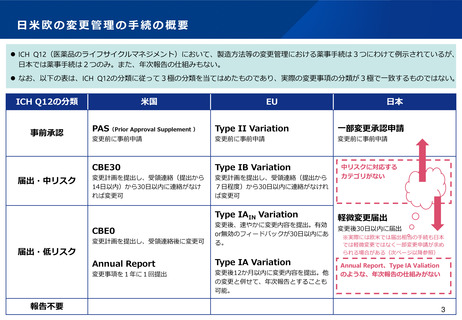
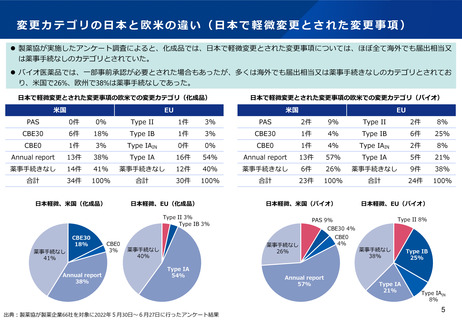
変更カテゴリの日本と欧米の違い(日本で一変とされた変更事項)
⚫ 製薬協が実施したアンケート調査によると、化成品では、日本で一変承認が必要とされた変更事項のうち、海外でも事前承認が必要と
された事項は、米国では38%、EUでは28%であり、多くはなかった。
⚫ バイオ医薬品では、50%以上は海外でも事前承認が必要とされたが、欧州では40%が、米国では25%が30日以内の審査又は薬事手続きな
しとされていた。
日本で一変とされた変更事項の欧米での変更カテゴリ(化成品)
米国
日本で一変とされた変更事項の欧米での変更カテゴリ(バイオ)
EU
米国
EU
PAS
11件
38%
Type II
8件
28%
PAS
21件
75%
Type II
18件
60%
CBE30
11件
38%
Type IB
16件
55%
CBE30
3件
11%
Type IB
8件
27%
CBE0
1件
4%
Type IAIN
0件
0%
CBE0
0件
0%
Type IAIN
0件
0%
Annual report
3件
10%
Type IA
2件
7%
Annual report
2件
7%
Type IA
1件
3%
薬事手続きなし
3件
10%
薬事手続きなし
3件
10%
薬事手続きなし
2件
7%
薬事手続きなし
3件
10%
合計
29件
100%
合計
29件
100%
合計
28件
100%
合計
30件
100%
日本一変、米国(化成品)
薬事手続なし
10%
日本一変、EU(化成品)
Type II
28%
PAS
38%
CBE0
4%
CBE30
38%
Type IB
55%
出典:製薬協が製薬企業66社を対象に2022年5月30日~6月27日に行ったアンケート結果
日本一変、EU(バイオ)
薬事手続なし
10%
Type IA
3%
薬事手続なし
7%
Annual report
7%
薬事手続なし
10%
Type IA
7%
Annual report
10%
日本一変、米国(バイオ)
CBE30
11%
PAS
75%
Type IB
27%
Type II
60%
4
⚫ 製薬協が実施したアンケート調査によると、化成品では、日本で一変承認が必要とされた変更事項のうち、海外でも事前承認が必要と
された事項は、米国では38%、EUでは28%であり、多くはなかった。
⚫ バイオ医薬品では、50%以上は海外でも事前承認が必要とされたが、欧州では40%が、米国では25%が30日以内の審査又は薬事手続きな
しとされていた。
日本で一変とされた変更事項の欧米での変更カテゴリ(化成品)
米国
日本で一変とされた変更事項の欧米での変更カテゴリ(バイオ)
EU
米国
EU
PAS
11件
38%
Type II
8件
28%
PAS
21件
75%
Type II
18件
60%
CBE30
11件
38%
Type IB
16件
55%
CBE30
3件
11%
Type IB
8件
27%
CBE0
1件
4%
Type IAIN
0件
0%
CBE0
0件
0%
Type IAIN
0件
0%
Annual report
3件
10%
Type IA
2件
7%
Annual report
2件
7%
Type IA
1件
3%
薬事手続きなし
3件
10%
薬事手続きなし
3件
10%
薬事手続きなし
2件
7%
薬事手続きなし
3件
10%
合計
29件
100%
合計
29件
100%
合計
28件
100%
合計
30件
100%
日本一変、米国(化成品)
薬事手続なし
10%
日本一変、EU(化成品)
Type II
28%
PAS
38%
CBE0
4%
CBE30
38%
Type IB
55%
出典:製薬協が製薬企業66社を対象に2022年5月30日~6月27日に行ったアンケート結果
日本一変、EU(バイオ)
薬事手続なし
10%
Type IA
3%
薬事手続なし
7%
Annual report
7%
薬事手続なし
10%
Type IA
7%
Annual report
10%
日本一変、米国(バイオ)
CBE30
11%
PAS
75%
Type IB
27%
Type II
60%
4