よむ、つかう、まなぶ。
○新医薬品の薬価収載について 総ー2ー1 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00231.html |
| 出典情報 | 中央社会保険医療協議会 総会(第572回 12/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
○
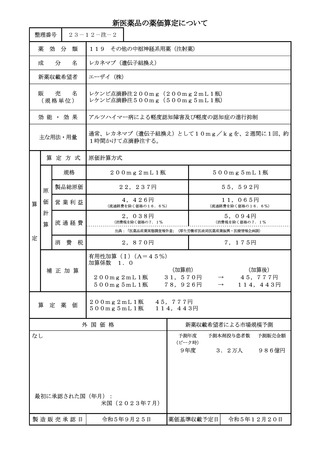
補正加算
◇ 本剤は、可溶性 Aβプロトフィブリルを標的とするモノクローナル抗体であり、審査報告書に
おいて
「ミクログリアによる食作用を介して可溶性 AβPF を除去するという新規作用機序により、
治療効果を発揮すると考えられている。」と評価されており、
「薬理作用発現のための薬剤の作用
点が既収載品目と異なる」に該当する。
(イ.新規作用機序(異なる作用点): ①-a=2p に該当)
◇ アルツハイマー型認知症患者を対象とした国際共同試験には、既存薬(ドネペジル等)による
治療中の患者も組み込まれており、既存薬の併用有無を解析した結果においても、本剤と併用す
ることで評価指標の変化量が大きいことが示されており、審査報告書において「本薬による Aβ
を標的とする本邦で初めての治療法を早期 AD 患者における新たな治療選択肢として臨床現場に
提供する意義はある」と評価されていることから、
「既存の治療方法では効果が不十分な患者群、
あるいは安全性等の理由で既存の治療方法が使用できない患者群において効果が認められる」に
該当する。
(ハ.治療方法の改善(不十分例): ③-a=1p に該当)
◇ 既収載品の効能効果が「アルツハイマー型認知症における認知症症状の進行抑制」とされてい
るところ、本剤は「アルツハイマー病による軽度認知障害及び軽度のアルツハイマー型認知症の
進行抑制」とされたことを踏まえると、軽度認知障害及び認知症の進行抑制が認められたものと
判断でき、本邦で初めての治療法であることから、
「特に著しい治療方法の改善が示されている」
と薬価算定組織が判断した。(ハ.治療方法の改善(著しく有用): ③-e=1p に該当)
◇ 上記により、イ及びハの評価項目を満たすことから、有用性加算(Ⅰ)となる。
(5p に該当)
⇒ 以上より、2p+1p+1p+5p=9p であり、1p=5%となるので、有用性加算(I)A=45%に該当
する。
(参考)
申請者からは以下の点も主張されたが、加算するまでの評価とはならなかった。
◇ アルツハイマー病は「病気の進行が不可逆的で、日常生活に著しい影響を及ぼす疾患」である
こと、既承認のアルツハイマー病の症状改善薬に臨床症状の進行速度を抑制する薬剤はないこ
とから、標準的治療法が確立されていない重篤な疾患を適応対象とするものと評価できる。
(算定組織判断)本剤は重症度の進行した範囲を対象としていないこと等から加算するまでの評
価とならない。
◇
本剤の臨床試験において、休薬後も効果が持続することが示唆され、また、日本の医療環境下
で標準治療に対してQALYを増加させるとともに介護費用等を含めた総費用を減少させるこ
とが示唆されたこと。
(算定組織判断)休薬後の効果持続は示唆されるに留まっていること、また、介護費用等の総費
用等にかかる主張については、現時点では企業の主張する内容の妥当性が判断できない。
8
補正加算
◇ 本剤は、可溶性 Aβプロトフィブリルを標的とするモノクローナル抗体であり、審査報告書に
おいて
「ミクログリアによる食作用を介して可溶性 AβPF を除去するという新規作用機序により、
治療効果を発揮すると考えられている。」と評価されており、
「薬理作用発現のための薬剤の作用
点が既収載品目と異なる」に該当する。
(イ.新規作用機序(異なる作用点): ①-a=2p に該当)
◇ アルツハイマー型認知症患者を対象とした国際共同試験には、既存薬(ドネペジル等)による
治療中の患者も組み込まれており、既存薬の併用有無を解析した結果においても、本剤と併用す
ることで評価指標の変化量が大きいことが示されており、審査報告書において「本薬による Aβ
を標的とする本邦で初めての治療法を早期 AD 患者における新たな治療選択肢として臨床現場に
提供する意義はある」と評価されていることから、
「既存の治療方法では効果が不十分な患者群、
あるいは安全性等の理由で既存の治療方法が使用できない患者群において効果が認められる」に
該当する。
(ハ.治療方法の改善(不十分例): ③-a=1p に該当)
◇ 既収載品の効能効果が「アルツハイマー型認知症における認知症症状の進行抑制」とされてい
るところ、本剤は「アルツハイマー病による軽度認知障害及び軽度のアルツハイマー型認知症の
進行抑制」とされたことを踏まえると、軽度認知障害及び認知症の進行抑制が認められたものと
判断でき、本邦で初めての治療法であることから、
「特に著しい治療方法の改善が示されている」
と薬価算定組織が判断した。(ハ.治療方法の改善(著しく有用): ③-e=1p に該当)
◇ 上記により、イ及びハの評価項目を満たすことから、有用性加算(Ⅰ)となる。
(5p に該当)
⇒ 以上より、2p+1p+1p+5p=9p であり、1p=5%となるので、有用性加算(I)A=45%に該当
する。
(参考)
申請者からは以下の点も主張されたが、加算するまでの評価とはならなかった。
◇ アルツハイマー病は「病気の進行が不可逆的で、日常生活に著しい影響を及ぼす疾患」である
こと、既承認のアルツハイマー病の症状改善薬に臨床症状の進行速度を抑制する薬剤はないこ
とから、標準的治療法が確立されていない重篤な疾患を適応対象とするものと評価できる。
(算定組織判断)本剤は重症度の進行した範囲を対象としていないこと等から加算するまでの評
価とならない。
◇
本剤の臨床試験において、休薬後も効果が持続することが示唆され、また、日本の医療環境下
で標準治療に対してQALYを増加させるとともに介護費用等を含めた総費用を減少させるこ
とが示唆されたこと。
(算定組織判断)休薬後の効果持続は示唆されるに留まっていること、また、介護費用等の総費
用等にかかる主張については、現時点では企業の主張する内容の妥当性が判断できない。
8