よむ、つかう、まなぶ。
06 参考資料2 おたふくかぜワクチン接種後の副反応に関する全国調査報告 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37506.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第23回 1/24)《厚生労働省 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
EDAIN WING 4.0 佐藤
2024.01.10 11.23.40
Page 3(1)
KyorinWPS/70573−8983/sho01−15/ky389353898310061948
日児誌
128(1),2024
93―(93)
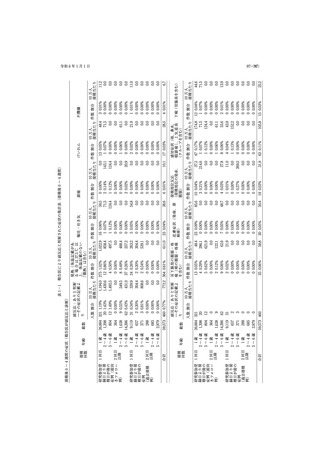
一方,2017 年に日本耳鼻咽喉科学会によるムンプス
医)が,おたふくかぜワクチン被接種者の接種後 4 週
難聴に関する全国調査の結果が公表され,ムンプスの
間,
ならびに 5〜8 週間の被接種者の健康状態を保護者
疾病負担が改めて認識された.ムンプスは,無菌性髄
に確認し,基本情報とともに,副反応が疑われる症状
膜炎(発生頻度 1〜10%)
,脳炎(同 0.02〜0.3%)
,聴力
の発生の有無について協力医が Web 入力を行い,情
障害(0.1〜0.25%)
,精巣炎(思春期以降の発症で 20〜
報収集した(一次調査).届出した医師はおたふくかぜ
40%)など合併症の多い小児期に好発する疾患であ
ワクチンの副反応とは考えていないが,上記期間に発
1)
る .予防接種制度の見直しについての第二次提言
生し,備考欄に記載されていた症状についても検討対
(2012 年 5 月)
において,おたふくかぜワクチンは広く
象とした.また,Web 入力が困難な調査協力医には,
接種を促進していくことが望ましいワクチンの一つに
FAX や書類の送付にて研究班で代行入力も行った.
位置付けられ,
早期の定期接種化を待望する声は強い.
一次調査で登録された無菌性髄膜炎など中枢神経系
また,小児科の臨床現場では,安全性の懸念事項であ
の副反応が疑われる症状を発症した症例については,
る接種後の無菌性髄膜炎について,近年の発生は少な
二次調査として,症状の経過や検査所見,転帰の情報
いという意見も多い.1 歳になったら早期に接種する
などを収集した.さらに,症状出現時に実施された検
ことで,年長児への接種と比較して副反応である無菌
査の残余検体(髄液,血液,便,尿,呼吸器由来検体)
性髄膜炎の発生頻度を低下させることができる可能性
を用いて,国立感染症研究所において病原体検索を実
や,昨今はエンテロウイルス属による無菌性髄膜炎の
施した.なお,診療の一環として各医療機関でのみ病
流行が認められず紛れ込み症例(誤分類症例)が少な
原体検索を実施した症例も含まれている.研究実施期
い可能性なども指摘されている.
間は,日本小児科学会理事会承認日(2020 年 12 月 20
そこで,おたふくかぜワクチン接種後の健康状態に
日)から 2024 年 3 月 31 日までとし,接種日は 2023
ついて,十分に信頼できる情報が収集できる体制で,
年 3 月 31 日までとした.
多数例に対する調査を実施する必要性が指摘された.
①情報登録への協力要請
副反応を疑う症状が出現した場合には,その症状経過
本 調 査 用 の 専 門 Web サ イ ト「Mumps Vaccine
や検査所見の精査により,可能な限り副反応か,ある
Safety Database(以下 Mu-VSD)
」
を構築し(URL:h
いは偶発的な有害事象かの評価を行って解析すること
ttps://mumps.children.jp)
(図 1)
,2021 年 3 月 21 日か
が重要である.ムンプスウイルスが検出された場合は
ら日本小児科学会会員に当調査を周知し,協力を依頼
野生株かワクチン株かの区別も不可欠である.さらに
した.なお,対象とするおたふくかぜワクチンの接種
は,ワクチンによる無菌性髄膜炎の頻度に加えて,そ
期間は 2020 年 1 月 1 日〜2023 年 3 月 31 日まで,Mu-
の重症度に関する情報や,脳炎や脳症など,より重篤
VSD への入力は,2021 年 3 月 21 日から 2023 年 6 月
な副反応が発生するリスクについても検討することが
24 日まで可能とした.
必要とされた.
本調査の調査協力医の募集は,日本小児科学会雑誌
以上の経緯から,現在国内で承認使用されている 2
第 125 巻第 3 号
(2021 年 3 月)に同封された案内冊子,
種類(星野株,鳥居株)のおたふくかぜワクチンにつ
リマインドとして,日本小児科学会の全会員への郵送
いて,日本小児科学会は日本医療研究開発機構(Japan
による調査協力依頼(2023 年 2 月)や,日本外来小児
Agency for Medical Research and Development(以
科学会,日本小児科医会,日本プライマリ・ケア連合
下,AMED)
)研究班
(AMED 鈴木班,AMED 菅班)と
学会,日本医師会,地方の小児科医会,NPO 法人 VPD
共同で調査研究を計画した.計数万例以上の 1 回目,
を知って,子どもを守ろうの会などの会員への通達に
2 回目,
3 回目以上のおたふくかぜワクチン被接種者に
て行われた.
ついて,接種後の健康状態を調査し,副反応が疑われ
②情報収集の方法と収集した情報の項目
る症例についてはさらに精査した.過去の安全性評価
おたふくかぜワクチンを接種した医師から,被接種
に関する既報告についても再度レビューし,本研究の
者の接種時の基本情報と接種後 4 週間まで,ならびに
結果と比較した.おたふくかぜワクチンによる無菌性
5〜8 週間の副反応が疑われる症状の発生の有無につ
髄膜炎を含む副反応の発生頻度と重篤度について評価
いて情報を Mu-VSD を用いて収集した.副反応が疑わ
し,定期接種化に関する技術的検討を行うための知見
れる症状の発生がなかった場合にも報告を求めた(図
とすることが,本研究の目的である.
1).なお,接種 4 週間と 8 週間の時点での健康状態に
方
法
全ての日本小児科学会会員に当調査を周知し,協力
を依頼した.調査に協力する医師(原則として,接種
ついては,医師が全被検者の保護者に電話,対面等で
確認した.
2024.01.10 11.23.40
Page 3(1)
KyorinWPS/70573−8983/sho01−15/ky389353898310061948
日児誌
128(1),2024
93―(93)
一方,2017 年に日本耳鼻咽喉科学会によるムンプス
医)が,おたふくかぜワクチン被接種者の接種後 4 週
難聴に関する全国調査の結果が公表され,ムンプスの
間,
ならびに 5〜8 週間の被接種者の健康状態を保護者
疾病負担が改めて認識された.ムンプスは,無菌性髄
に確認し,基本情報とともに,副反応が疑われる症状
膜炎(発生頻度 1〜10%)
,脳炎(同 0.02〜0.3%)
,聴力
の発生の有無について協力医が Web 入力を行い,情
障害(0.1〜0.25%)
,精巣炎(思春期以降の発症で 20〜
報収集した(一次調査).届出した医師はおたふくかぜ
40%)など合併症の多い小児期に好発する疾患であ
ワクチンの副反応とは考えていないが,上記期間に発
1)
る .予防接種制度の見直しについての第二次提言
生し,備考欄に記載されていた症状についても検討対
(2012 年 5 月)
において,おたふくかぜワクチンは広く
象とした.また,Web 入力が困難な調査協力医には,
接種を促進していくことが望ましいワクチンの一つに
FAX や書類の送付にて研究班で代行入力も行った.
位置付けられ,
早期の定期接種化を待望する声は強い.
一次調査で登録された無菌性髄膜炎など中枢神経系
また,小児科の臨床現場では,安全性の懸念事項であ
の副反応が疑われる症状を発症した症例については,
る接種後の無菌性髄膜炎について,近年の発生は少な
二次調査として,症状の経過や検査所見,転帰の情報
いという意見も多い.1 歳になったら早期に接種する
などを収集した.さらに,症状出現時に実施された検
ことで,年長児への接種と比較して副反応である無菌
査の残余検体(髄液,血液,便,尿,呼吸器由来検体)
性髄膜炎の発生頻度を低下させることができる可能性
を用いて,国立感染症研究所において病原体検索を実
や,昨今はエンテロウイルス属による無菌性髄膜炎の
施した.なお,診療の一環として各医療機関でのみ病
流行が認められず紛れ込み症例(誤分類症例)が少な
原体検索を実施した症例も含まれている.研究実施期
い可能性なども指摘されている.
間は,日本小児科学会理事会承認日(2020 年 12 月 20
そこで,おたふくかぜワクチン接種後の健康状態に
日)から 2024 年 3 月 31 日までとし,接種日は 2023
ついて,十分に信頼できる情報が収集できる体制で,
年 3 月 31 日までとした.
多数例に対する調査を実施する必要性が指摘された.
①情報登録への協力要請
副反応を疑う症状が出現した場合には,その症状経過
本 調 査 用 の 専 門 Web サ イ ト「Mumps Vaccine
や検査所見の精査により,可能な限り副反応か,ある
Safety Database(以下 Mu-VSD)
」
を構築し(URL:h
いは偶発的な有害事象かの評価を行って解析すること
ttps://mumps.children.jp)
(図 1)
,2021 年 3 月 21 日か
が重要である.ムンプスウイルスが検出された場合は
ら日本小児科学会会員に当調査を周知し,協力を依頼
野生株かワクチン株かの区別も不可欠である.さらに
した.なお,対象とするおたふくかぜワクチンの接種
は,ワクチンによる無菌性髄膜炎の頻度に加えて,そ
期間は 2020 年 1 月 1 日〜2023 年 3 月 31 日まで,Mu-
の重症度に関する情報や,脳炎や脳症など,より重篤
VSD への入力は,2021 年 3 月 21 日から 2023 年 6 月
な副反応が発生するリスクについても検討することが
24 日まで可能とした.
必要とされた.
本調査の調査協力医の募集は,日本小児科学会雑誌
以上の経緯から,現在国内で承認使用されている 2
第 125 巻第 3 号
(2021 年 3 月)に同封された案内冊子,
種類(星野株,鳥居株)のおたふくかぜワクチンにつ
リマインドとして,日本小児科学会の全会員への郵送
いて,日本小児科学会は日本医療研究開発機構(Japan
による調査協力依頼(2023 年 2 月)や,日本外来小児
Agency for Medical Research and Development(以
科学会,日本小児科医会,日本プライマリ・ケア連合
下,AMED)
)研究班
(AMED 鈴木班,AMED 菅班)と
学会,日本医師会,地方の小児科医会,NPO 法人 VPD
共同で調査研究を計画した.計数万例以上の 1 回目,
を知って,子どもを守ろうの会などの会員への通達に
2 回目,
3 回目以上のおたふくかぜワクチン被接種者に
て行われた.
ついて,接種後の健康状態を調査し,副反応が疑われ
②情報収集の方法と収集した情報の項目
る症例についてはさらに精査した.過去の安全性評価
おたふくかぜワクチンを接種した医師から,被接種
に関する既報告についても再度レビューし,本研究の
者の接種時の基本情報と接種後 4 週間まで,ならびに
結果と比較した.おたふくかぜワクチンによる無菌性
5〜8 週間の副反応が疑われる症状の発生の有無につ
髄膜炎を含む副反応の発生頻度と重篤度について評価
いて情報を Mu-VSD を用いて収集した.副反応が疑わ
し,定期接種化に関する技術的検討を行うための知見
れる症状の発生がなかった場合にも報告を求めた(図
とすることが,本研究の目的である.
1).なお,接種 4 週間と 8 週間の時点での健康状態に
方
法
全ての日本小児科学会会員に当調査を周知し,協力
を依頼した.調査に協力する医師(原則として,接種
ついては,医師が全被検者の保護者に電話,対面等で
確認した.