よむ、つかう、まなぶ。
03 資料1_海外製インフルエンザワクチンの製造株選定に伴う薬事関係の具体的なスケジュール等について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37873.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会研究開発及び生産・流通部会(第34回 2/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
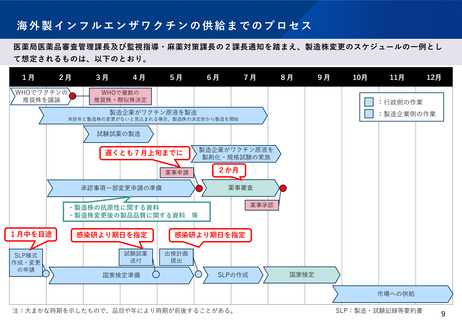
国内のインフルエンザワクチンの供給までのプロセス
第31回厚生科学審議会予防接種・ワクチン分科会
研 究 開 発 及 び 生 産 ・ 流 通 部 会 資料1
2023(令和5)年1月25日
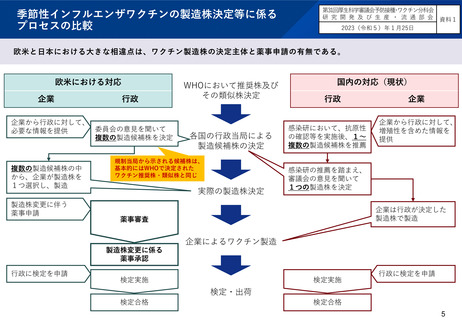
本邦の季節性インフルエンザワクチン製造に関する特徴
•
ワクチン製造に使用する株については、WHOで決定された推奨株・類似株の中から、国内の臨床分離株への血清の反応性や製造
効率の検討結果等を踏まえ、4月頃に、4種類のウイルスごとに1つの製造株を厚生労働省が決定する。
➢
•
A型はH1N1とH3N2、B型はビクトリア系統と山形系統からワクチンを製造している
感染研と製造企業が協同してワクチンの力価試験に使用する試薬を作成して、WHO-ERL(WHOワクチン品質管理ラボ)の較正
後、7月上旬頃に感染研から製造企業に配布される。
1月
2月
3月
WHOでワクチンの
推奨株を議論
WHOの推奨株・類似株
を踏まえ、感染研
から製造候補株を分与
4月
5月
WHOで複数の
推奨株・類似株決定
製造企業で
製造効率確認
感染研で製造
候補株の検討
感染研で
候補株決定
厚
科
審
6月
7月
8月
9月
10月
11月
12月
製造株の変更は、感染研での検討や厚生科学審議会での議論を経て
4月中下旬に健康局長通知により1つの製造株を周知している。
この際、薬事上の手続きは不要となっている
供給量
報告
健康局長名で決定
された製造株を通知
(厚科審)
:行政側の作業
:製造企業側の作業
製造企業がワクチン原液を製造・規格試験の実施
※前年と製造株の変更がないと見込まれる場合、製造株の決定前から製造を開始
感染研・製造企業で力価試験に使用する試薬を作成
試薬は製造企業に製造を WHO-ERL(*)で試薬の較正実施
委託し、製造企業が作成
する試薬は、国内4社が
分担して作成
力価試験に使用する試薬を
感染研から製造企業に配布
*
WHO-ERLはWHOワクチン品質管理ラボ
としてインフルエンザワクチンの標準化等
の役割を果たしている
注:大まかな時期を示したもので、年により時期が前後することがある
製造企業がワクチン原液を製剤化・規格試験の実施
感染研による国家検定
※通常は1ロット当たり30日程度(標準事務処理期間80日)
市場への供給
15
第31回厚生科学審議会予防接種・ワクチン分科会
研 究 開 発 及 び 生 産 ・ 流 通 部 会 資料1
2023(令和5)年1月25日
本邦の季節性インフルエンザワクチン製造に関する特徴
•
ワクチン製造に使用する株については、WHOで決定された推奨株・類似株の中から、国内の臨床分離株への血清の反応性や製造
効率の検討結果等を踏まえ、4月頃に、4種類のウイルスごとに1つの製造株を厚生労働省が決定する。
➢
•
A型はH1N1とH3N2、B型はビクトリア系統と山形系統からワクチンを製造している
感染研と製造企業が協同してワクチンの力価試験に使用する試薬を作成して、WHO-ERL(WHOワクチン品質管理ラボ)の較正
後、7月上旬頃に感染研から製造企業に配布される。
1月
2月
3月
WHOでワクチンの
推奨株を議論
WHOの推奨株・類似株
を踏まえ、感染研
から製造候補株を分与
4月
5月
WHOで複数の
推奨株・類似株決定
製造企業で
製造効率確認
感染研で製造
候補株の検討
感染研で
候補株決定
厚
科
審
6月
7月
8月
9月
10月
11月
12月
製造株の変更は、感染研での検討や厚生科学審議会での議論を経て
4月中下旬に健康局長通知により1つの製造株を周知している。
この際、薬事上の手続きは不要となっている
供給量
報告
健康局長名で決定
された製造株を通知
(厚科審)
:行政側の作業
:製造企業側の作業
製造企業がワクチン原液を製造・規格試験の実施
※前年と製造株の変更がないと見込まれる場合、製造株の決定前から製造を開始
感染研・製造企業で力価試験に使用する試薬を作成
試薬は製造企業に製造を WHO-ERL(*)で試薬の較正実施
委託し、製造企業が作成
する試薬は、国内4社が
分担して作成
力価試験に使用する試薬を
感染研から製造企業に配布
*
WHO-ERLはWHOワクチン品質管理ラボ
としてインフルエンザワクチンの標準化等
の役割を果たしている
注:大まかな時期を示したもので、年により時期が前後することがある
製造企業がワクチン原液を製剤化・規格試験の実施
感染研による国家検定
※通常は1ロット当たり30日程度(標準事務処理期間80日)
市場への供給
15