よむ、つかう、まなぶ。
03 資料1_海外製インフルエンザワクチンの製造株選定に伴う薬事関係の具体的なスケジュール等について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37873.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会研究開発及び生産・流通部会(第34回 2/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
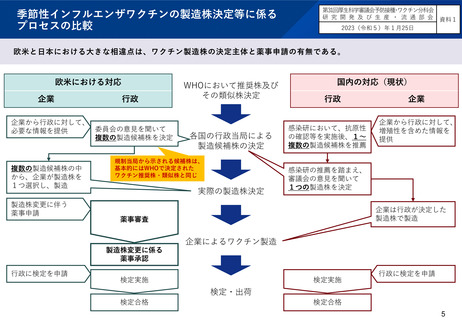
WHO推奨株(又はその類似株)の中から自社で選定した株を用いて製造
されるインフルエンザワクチンの製造株変更に伴う取扱いについて
薬事関係の申請資料や具体的なスケジュール等については医薬局医薬品審査管理課長及び監視指導・麻薬対策課長の
2課長通知で示されている。その概略は以下のとおり。
薬事審査における申請資料・スケジュール
•
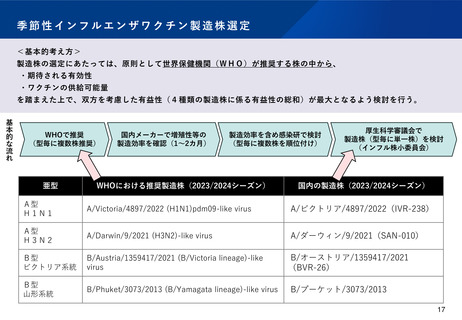
WHO推奨株(又はその類似株)の中から自社で選定した株を用いて製造されるインフルエンザワクチンについて、製造株を変更する
場合は、一変承認を受ける必要がある。
•
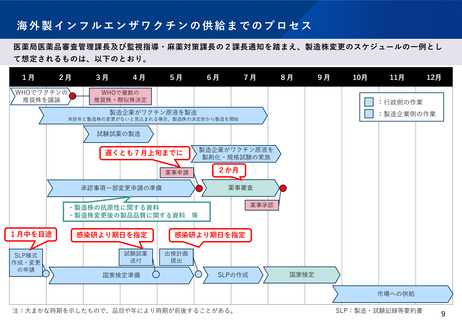
国内でインフルエンザが流行する時期までにインフルエンザワクチンを供給するために、製造株変更を行う場合は一変申請を実施
【遅くとも7月上旬まで】 。
•
一変申請にあたっては、PMDAと相談の上、以下の資料のうち該当するものを提出する。なお、一変申請前であっても、事前に資料
の準備ができている場合には、事前に提出する。
➢
製造株の抗原性に関する資料(例:WHO推奨株と製造株の抗原性の類似性、遺伝子配列に関するデータ等)
➢
製造株変更後の製品品質に関する資料(例:マスターウイルスシード(MVS)の管理試験結果、原薬・製剤等を製造した際の
ロット分析結果(規格試験の成績等)、安定性データの取得予定等)
➢
その他厚生労働省及びPMDAとの協議の上で必要とされた資料
•
一変申請から一変承認までの標準的事務処理期間は2か月。(※迅速な審査のため、一変申請には製造株の変更に伴う変更以外の内
容は含めないことが前提)
•
一変申請に係るGMP適合性調査は不要。
国家検定のスケジュール
•
国家検定に用いる試験試薬の事前検査結果に関する報告資料、試験試薬の送付【国立感染症研究所より指定された期日まで】。
•
国立感染症研究所に製造・試験記録等要約書様式(SLP様式)の作成や変更の申請【出検を行う年の1月中を目途】。
•
国家検定の出検スケジュール・出検計画の提出【国立感染症研究所より指定された期日まで】。
国立感染症研究所が交付する株以外の株を用いて製造されるインフルエンザワクチンの取扱い等について(令和6年1月31日付け医薬薬審発0131第1号、医薬監
麻発0131第1号厚生労働省医薬局医薬品審査管理課長、監視指導・麻薬対策課長連名通知) より抜粋・要約
8
されるインフルエンザワクチンの製造株変更に伴う取扱いについて
薬事関係の申請資料や具体的なスケジュール等については医薬局医薬品審査管理課長及び監視指導・麻薬対策課長の
2課長通知で示されている。その概略は以下のとおり。
薬事審査における申請資料・スケジュール
•
WHO推奨株(又はその類似株)の中から自社で選定した株を用いて製造されるインフルエンザワクチンについて、製造株を変更する
場合は、一変承認を受ける必要がある。
•
国内でインフルエンザが流行する時期までにインフルエンザワクチンを供給するために、製造株変更を行う場合は一変申請を実施
【遅くとも7月上旬まで】 。
•
一変申請にあたっては、PMDAと相談の上、以下の資料のうち該当するものを提出する。なお、一変申請前であっても、事前に資料
の準備ができている場合には、事前に提出する。
➢
製造株の抗原性に関する資料(例:WHO推奨株と製造株の抗原性の類似性、遺伝子配列に関するデータ等)
➢
製造株変更後の製品品質に関する資料(例:マスターウイルスシード(MVS)の管理試験結果、原薬・製剤等を製造した際の
ロット分析結果(規格試験の成績等)、安定性データの取得予定等)
➢
その他厚生労働省及びPMDAとの協議の上で必要とされた資料
•
一変申請から一変承認までの標準的事務処理期間は2か月。(※迅速な審査のため、一変申請には製造株の変更に伴う変更以外の内
容は含めないことが前提)
•
一変申請に係るGMP適合性調査は不要。
国家検定のスケジュール
•
国家検定に用いる試験試薬の事前検査結果に関する報告資料、試験試薬の送付【国立感染症研究所より指定された期日まで】。
•
国立感染症研究所に製造・試験記録等要約書様式(SLP様式)の作成や変更の申請【出検を行う年の1月中を目途】。
•
国家検定の出検スケジュール・出検計画の提出【国立感染症研究所より指定された期日まで】。
国立感染症研究所が交付する株以外の株を用いて製造されるインフルエンザワクチンの取扱い等について(令和6年1月31日付け医薬薬審発0131第1号、医薬監
麻発0131第1号厚生労働省医薬局医薬品審査管理課長、監視指導・麻薬対策課長連名通知) より抜粋・要約
8