よむ、つかう、まなぶ。
【資料1-2】業界の取組 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38628.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第11回 3/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
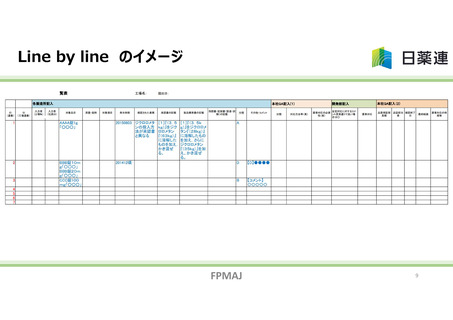
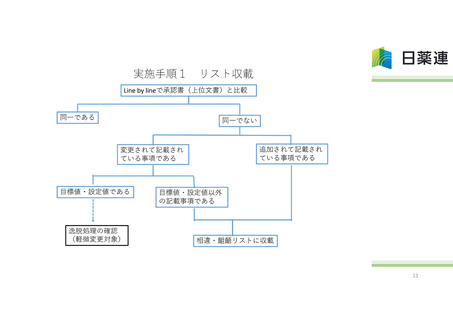
承認書と製造実態の整合性に係る自主点検の内容
これまでの自主点検では不適切事案の再発を未然に防止しきれていない事実を猛省し、新たに次の観点を組入れた自主点検の項目・
手技・手順を定め、日薬連とJGAが密に連携を取り業界全体で上述の課題の早期解消に取組む
自主点検実施範囲の拡大
: 薬価基準収載されている全ての後発医薬品を対象とする
不適切事案に基づく項目の追加
: 行政処分事例を考慮した再発防止に向け、必須の点検項目を拡充する
炙り出せない不適切事案への対応 : 公益通報制度の周知、コンプライアンス教育とガバナンス体制の充実による自浄作用を醸成する
骨格となる事項
•
•
•
•
•
•
•
•
承認書記載事項と製造/試験実態の整合性調査の恒常化・標準化
製造・品質検査手順の書面調査に加え従事者へのヒアリングによる実情確認
製造実態が承認書から逸脱していることが判明した際の対応手順の設定
変更管理検討時に承認書の変更手続きの必要性を検討・実施することを保証する体制の構築
委託先への承認書記載事項変更連絡や受託先からの製造方法等の変更連絡の徹底
統一手順による点検の標準化
個社の実態に沿った点検計画及び進捗状況のHP上公開(可視化)
自主点検結果の行政報告(厚生労働省及び都道府県)とHP上への順次公開
FPMAJ
4
これまでの自主点検では不適切事案の再発を未然に防止しきれていない事実を猛省し、新たに次の観点を組入れた自主点検の項目・
手技・手順を定め、日薬連とJGAが密に連携を取り業界全体で上述の課題の早期解消に取組む
自主点検実施範囲の拡大
: 薬価基準収載されている全ての後発医薬品を対象とする
不適切事案に基づく項目の追加
: 行政処分事例を考慮した再発防止に向け、必須の点検項目を拡充する
炙り出せない不適切事案への対応 : 公益通報制度の周知、コンプライアンス教育とガバナンス体制の充実による自浄作用を醸成する
骨格となる事項
•
•
•
•
•
•
•
•
承認書記載事項と製造/試験実態の整合性調査の恒常化・標準化
製造・品質検査手順の書面調査に加え従事者へのヒアリングによる実情確認
製造実態が承認書から逸脱していることが判明した際の対応手順の設定
変更管理検討時に承認書の変更手続きの必要性を検討・実施することを保証する体制の構築
委託先への承認書記載事項変更連絡や受託先からの製造方法等の変更連絡の徹底
統一手順による点検の標準化
個社の実態に沿った点検計画及び進捗状況のHP上公開(可視化)
自主点検結果の行政報告(厚生労働省及び都道府県)とHP上への順次公開
FPMAJ
4