よむ、つかう、まなぶ。
【資料1-2】業界の取組 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38628.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第11回 3/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
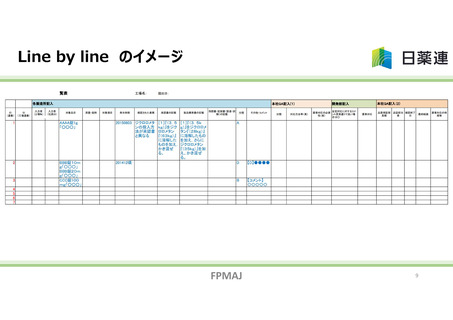
承認書と製造実態の整合性に係る自主点検範囲
2021年~2022年
・実施期間 2021年3月~2022年
・実施対象 日本ジェネリック製薬協会34社の後発医薬品(後発医薬品の約7割6396品目)
・実施範囲 「製造方法欄」
・実施結果 34社すべて終了
2024年4月~
〇実施対象を後発医薬品の製造販売承認を有する企業184社
・実施期間 2024年4月~2024年10月
・実施対象 薬価基準収載されている全ての後発医薬品
9341品目(2024年1月時点)
・実施範囲 「製造方法欄」、「規格及び試験方法欄」及び「別紙規格欄」
FPMAJ
6
2021年~2022年
・実施期間 2021年3月~2022年
・実施対象 日本ジェネリック製薬協会34社の後発医薬品(後発医薬品の約7割6396品目)
・実施範囲 「製造方法欄」
・実施結果 34社すべて終了
2024年4月~
〇実施対象を後発医薬品の製造販売承認を有する企業184社
・実施期間 2024年4月~2024年10月
・実施対象 薬価基準収載されている全ての後発医薬品
9341品目(2024年1月時点)
・実施範囲 「製造方法欄」、「規格及び試験方法欄」及び「別紙規格欄」
FPMAJ
6