よむ、つかう、まなぶ。
参考資料14 定期の予防接種等による副反応疑いの報告等の取扱いについて(平成25年3月30日付け健発0330第3号・薬食発0330第1号厚生労働省健康局長及び医薬食品局長連名通知。最終改正:令和6年3月29日)[1.6MB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_39491.html |
| 出典情報 | 予防接種・ワクチン分科会副反応検討部会(第101回 4/15)医薬品等安全対策部会安全対策調査会(令和6年度第1回 4/15)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
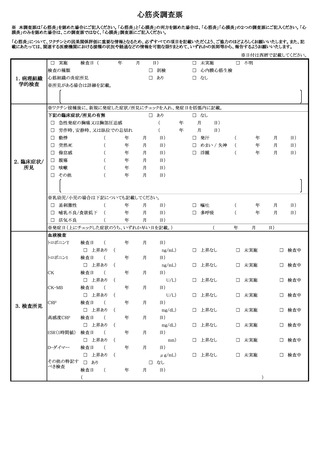
(6)過去にヒトパピローマウイルス感染症の定期の予防接種又は任意接種を受けた後
に広範な慢性の疼痛又は運動障害を中心とする多様な症状が発生した患者であっ
て、既に当該症状については治療を受けていないものについても、(3)又は(4)
と同様に取り扱うこと。
(7)ヒトパピローマウイルス感染症の定期の予防接種(キャッチアップ接種を含
む。)にあっては、当該症状が、組換え沈降2価ヒトパピローマウイルス様粒子
ワクチン又は組換え沈降4価ヒトパピローマウイルス様粒子ワクチンを用いて規
定の回数の一部を完了した者が、残りの接種を組換え沈降9価ヒトパピローマウ
イルス様粒子ワクチンで完了させる接種(以下「交互接種」という。)の後に生
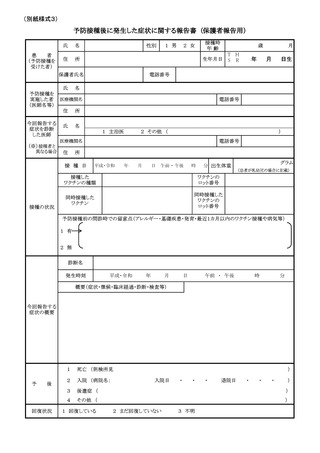
じたものである場合、別紙様式1「接種の状況」欄に予診票での留意点としてそ
の旨を明記すること(詳細な記載方法については別紙様式1記入要領を参照する
こと)。
(8)ヒトパピローマウイルス感染症のキャッチアップ接種において、過去に接種した
ヒトパピローマウイルス様粒子ワクチンの種類が不明の場合については、結果とし
て、異なる種類のワクチンが接種される可能性があるため、別紙様式1「接種の状
況」欄に予診票での留意点として過去に接種したヒトパピローマウイルス様粒子ワ
クチンの種類が不明である旨を明記すること。
5
新型コロナウイルス感染症の定期の予防接種等又は任意接種に係る対応
新型コロナワクチンについては、これまでワクチン接種との因果関係が示されてい
ない症状も含め、幅広く評価を行っていく必要があることから、当面の間、以下の症
状については当該規定による副反応疑い報告を積極的に行うよう検討するとともに、
これら以外の症状についても必要に応じて報告を検討すること。
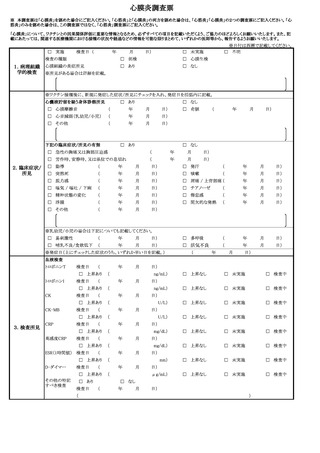
けいれん(ただし、熱性けいれんを除く。)、ギラン・バレ症候群、急性散在性脳
脊髄炎(ADEM)、血小板減少性紫斑病、血管炎、無菌性髄膜炎、脳炎・脳症、関
節炎、脊髄炎、顔面神経麻痺、血管迷走神経反射(失神を伴うもの)
また、副反応疑い報告基準に基づき、
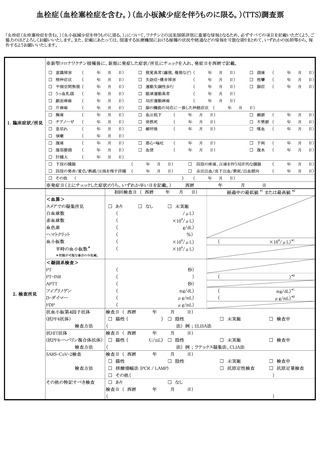
「血栓症(TTS)」、
「心筋炎」又は「心膜炎」
について報告する場合にあっては、1(1)を参照すること。
なお、令和6年3月 31 日までに行われた特例臨時接種に関して、令和6年4月1日
以降に副反応疑い報告基準に定める症状を呈していることを知ったときについても、
1(1)に示す方法に沿って副反応疑い報告を提出すること。
以上
に広範な慢性の疼痛又は運動障害を中心とする多様な症状が発生した患者であっ
て、既に当該症状については治療を受けていないものについても、(3)又は(4)
と同様に取り扱うこと。
(7)ヒトパピローマウイルス感染症の定期の予防接種(キャッチアップ接種を含
む。)にあっては、当該症状が、組換え沈降2価ヒトパピローマウイルス様粒子
ワクチン又は組換え沈降4価ヒトパピローマウイルス様粒子ワクチンを用いて規
定の回数の一部を完了した者が、残りの接種を組換え沈降9価ヒトパピローマウ
イルス様粒子ワクチンで完了させる接種(以下「交互接種」という。)の後に生
じたものである場合、別紙様式1「接種の状況」欄に予診票での留意点としてそ
の旨を明記すること(詳細な記載方法については別紙様式1記入要領を参照する
こと)。
(8)ヒトパピローマウイルス感染症のキャッチアップ接種において、過去に接種した
ヒトパピローマウイルス様粒子ワクチンの種類が不明の場合については、結果とし
て、異なる種類のワクチンが接種される可能性があるため、別紙様式1「接種の状
況」欄に予診票での留意点として過去に接種したヒトパピローマウイルス様粒子ワ
クチンの種類が不明である旨を明記すること。
5
新型コロナウイルス感染症の定期の予防接種等又は任意接種に係る対応
新型コロナワクチンについては、これまでワクチン接種との因果関係が示されてい
ない症状も含め、幅広く評価を行っていく必要があることから、当面の間、以下の症
状については当該規定による副反応疑い報告を積極的に行うよう検討するとともに、
これら以外の症状についても必要に応じて報告を検討すること。
けいれん(ただし、熱性けいれんを除く。)、ギラン・バレ症候群、急性散在性脳
脊髄炎(ADEM)、血小板減少性紫斑病、血管炎、無菌性髄膜炎、脳炎・脳症、関
節炎、脊髄炎、顔面神経麻痺、血管迷走神経反射(失神を伴うもの)
また、副反応疑い報告基準に基づき、
「血栓症(TTS)」、
「心筋炎」又は「心膜炎」
について報告する場合にあっては、1(1)を参照すること。
なお、令和6年3月 31 日までに行われた特例臨時接種に関して、令和6年4月1日
以降に副反応疑い報告基準に定める症状を呈していることを知ったときについても、
1(1)に示す方法に沿って副反応疑い報告を提出すること。
以上