よむ、つかう、まなぶ。
資料1:臨床研究法の見直しに係る各論点について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
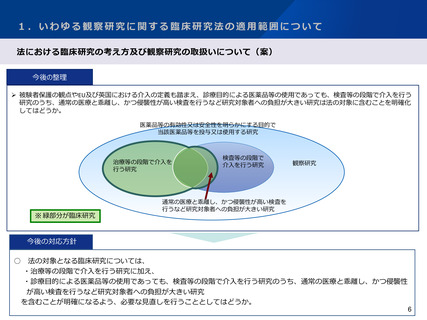
1.いわゆる観察研究に関する臨床研究法の適用範囲について
臨床研究法の対象範囲における見直しの方向性(案)
【従来の臨床研究法の対象範囲】
医薬品等※の使用
検査等
臨床研究法の対象になるか否
か
1.あらかじめ作成した研究計画に従って、患者
に対し医薬品等を使用
(内容問わず)
対象
2.個々の患者の病状に応じて、当該患者にとっ
て適切な医療として、医薬品等を使用
下記以外
対象
患者への傷害・負担が小さい研究目的
の検査等を診療に追加して行う場合
対象外*
診療に必要な範囲の検査等のみ
(研究目的の検査等は行わない)
対象外
検査等
臨床研究法の対象になるか
否か
1.あらかじめ作成した研究計画に従って、患者
に対し医薬品等を使用
(内容問わず)
対象
2.個々の患者の病状に応じて、当該患者にとっ
て適切な医療として、医薬品等を使用
通常の医療に比べて患者への傷害・負
担が大きい研究目的の検査等を診療に
追加して行う場合
対象
上記以外
対象外
診療に必要な範囲の検査等のみ(研究
目的の検査等は行わない)
対象外
(※医薬品、医療機器、再生医療等製品)
3.個々の患者の病状に応じて、当該患者にとっ
て適切な医療として、医薬品等を使用
(*Q&Aにより示されている考え方)
【見直し後の臨床研究法の対象範囲】
医薬品等※の使用
(※医薬品、医療機器、再生医療等製品)
3.個々の患者の病状に応じて、当該患者にとっ
て適切な医療として、医薬品等を使用
4
臨床研究法の対象範囲における見直しの方向性(案)
【従来の臨床研究法の対象範囲】
医薬品等※の使用
検査等
臨床研究法の対象になるか否
か
1.あらかじめ作成した研究計画に従って、患者
に対し医薬品等を使用
(内容問わず)
対象
2.個々の患者の病状に応じて、当該患者にとっ
て適切な医療として、医薬品等を使用
下記以外
対象
患者への傷害・負担が小さい研究目的
の検査等を診療に追加して行う場合
対象外*
診療に必要な範囲の検査等のみ
(研究目的の検査等は行わない)
対象外
検査等
臨床研究法の対象になるか
否か
1.あらかじめ作成した研究計画に従って、患者
に対し医薬品等を使用
(内容問わず)
対象
2.個々の患者の病状に応じて、当該患者にとっ
て適切な医療として、医薬品等を使用
通常の医療に比べて患者への傷害・負
担が大きい研究目的の検査等を診療に
追加して行う場合
対象
上記以外
対象外
診療に必要な範囲の検査等のみ(研究
目的の検査等は行わない)
対象外
(※医薬品、医療機器、再生医療等製品)
3.個々の患者の病状に応じて、当該患者にとっ
て適切な医療として、医薬品等を使用
(*Q&Aにより示されている考え方)
【見直し後の臨床研究法の対象範囲】
医薬品等※の使用
(※医薬品、医療機器、再生医療等製品)
3.個々の患者の病状に応じて、当該患者にとっ
て適切な医療として、医薬品等を使用
4