よむ、つかう、まなぶ。
資料1-8 「「疾病の兆候を検出し受診を促す家庭用医療機器の承認申請に当たって留意すべき事項について」の一部改正について」の一部改正について[780KB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41653.html |
| 出典情報 | 薬事審議会 医療機器・再生医療等製品安全対策部会(令和6年度第1回 8/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
薬 生 機 審 発 1213 第 4 号
薬 生 安 発 1213 第 3 号
令 和 4 年 12 月 13 日
[一部改正]令和6年6月 21 日
各都道府県衛生主管部(局)長
殿
厚生労働省医薬・生活衛生局医療機器審査管理課長
(
公
印
省
略
)
厚生労働省医薬・生活衛生局医薬安全対策課 長
(
公
印
省
略
)
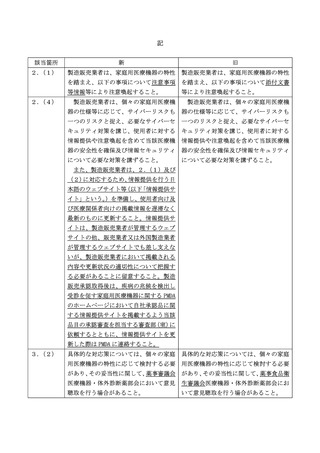
「疾病の兆候を検出し受診を促す家庭用医療機器の承認申請に当たって
留意すべき事項について」の一部改正について
近年、様々な技術の進展を受け、疾病の兆候を検出し受診を促すことを目的とした
医療機器プログラムをはじめとした家庭用医療機器の開発・実用化が進んでおり、疾
病の兆候を検出し受診を促す家庭用医療機器の承認申請に当たって留意すべき事項
については、「疾病の兆候を検出し受診を促す家庭用医療機器の承認申請に当たって
留意すべき事項について」(令和2年 10 月 26 日付け薬生機審発 1026 第1号・薬生
安発 1026 第1号厚生労働省医薬・生活衛生局医療機器審査管理課長・医薬安全対策
課長連名通知)により示したところです。
今般、規制改革実施計画(令和4年6月7日閣議決定)において、①医薬品医療機
器等法の承認を受けたスマートウォッチその他の家庭用医療機器(医師による使用・
管理を前提としない、家庭や職場に設置され使用される医療機器)によって兆候を検
出した疾病名(現在罹患している又は将来罹患する可能性がある疾病名)を表示する
ことが可能であることを明確にすること、②各種のバイタルデータに基づいて、現在
罹患している又は将来罹患する可能性がある疾病名を表示する機器について、当該製
品が使用者に提供する情報の臨床的意義が確立しているか、使用者自らが結果を解釈
し、受診の要否の判断を含めて適切な行動に繋げられるか等の観点からの判断等が必
要であることを具体的に記載すること、③スタートアップが上記医療機器を開発し製
造する可能性や不特定多数の利用が想定されること、当該機器には侵襲性がないこと
などを踏まえ、開発者に過度な負担とならないよう配慮しつつ、製造販売後の情報収
集の方法を明確化することとされたことから、下記のとおり改正することとし、貴管
下関係団体、関係事業者等に周知方お願いします。
薬 生 安 発 1213 第 3 号
令 和 4 年 12 月 13 日
[一部改正]令和6年6月 21 日
各都道府県衛生主管部(局)長
殿
厚生労働省医薬・生活衛生局医療機器審査管理課長
(
公
印
省
略
)
厚生労働省医薬・生活衛生局医薬安全対策課 長
(
公
印
省
略
)
「疾病の兆候を検出し受診を促す家庭用医療機器の承認申請に当たって
留意すべき事項について」の一部改正について
近年、様々な技術の進展を受け、疾病の兆候を検出し受診を促すことを目的とした
医療機器プログラムをはじめとした家庭用医療機器の開発・実用化が進んでおり、疾
病の兆候を検出し受診を促す家庭用医療機器の承認申請に当たって留意すべき事項
については、「疾病の兆候を検出し受診を促す家庭用医療機器の承認申請に当たって
留意すべき事項について」(令和2年 10 月 26 日付け薬生機審発 1026 第1号・薬生
安発 1026 第1号厚生労働省医薬・生活衛生局医療機器審査管理課長・医薬安全対策
課長連名通知)により示したところです。
今般、規制改革実施計画(令和4年6月7日閣議決定)において、①医薬品医療機
器等法の承認を受けたスマートウォッチその他の家庭用医療機器(医師による使用・
管理を前提としない、家庭や職場に設置され使用される医療機器)によって兆候を検
出した疾病名(現在罹患している又は将来罹患する可能性がある疾病名)を表示する
ことが可能であることを明確にすること、②各種のバイタルデータに基づいて、現在
罹患している又は将来罹患する可能性がある疾病名を表示する機器について、当該製
品が使用者に提供する情報の臨床的意義が確立しているか、使用者自らが結果を解釈
し、受診の要否の判断を含めて適切な行動に繋げられるか等の観点からの判断等が必
要であることを具体的に記載すること、③スタートアップが上記医療機器を開発し製
造する可能性や不特定多数の利用が想定されること、当該機器には侵襲性がないこと
などを踏まえ、開発者に過度な負担とならないよう配慮しつつ、製造販売後の情報収
集の方法を明確化することとされたことから、下記のとおり改正することとし、貴管
下関係団体、関係事業者等に周知方お願いします。