よむ、つかう、まなぶ。
議題3 参考資料5(先-5) (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42187.html |
| 出典情報 | 先進医療会議(第134回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
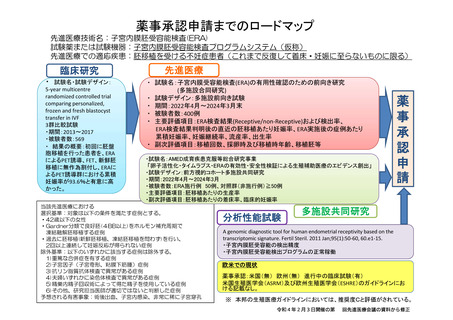
薬事承認申請までのロードマップ
先進医療技術名:子宮内膜胚受容能検査(ERA)
試験薬または試験機器:子宮内膜胚受容能検査プログラムシステム(仮称)
先進医療での適応疾患:胚移植を受ける不妊症患者(これまで反復して着床・妊娠に至らないものに限る)
臨床研究
・ 試験名・試験デザイン:
5-year multicentre
randomized controlled trial
comparing personalized,
frozen and fresh blastocyst
transfer in IVF
3群比較試験
・期間:2013~2017
・被験者数:569
・ 結果の概要:初回に胚盤
胞移植を行った患者を、ERA
によるPET誘導、FET、新鮮胚
移植に無作為割付し、ERAに
よるPET誘導群における累積
妊娠率が93.6%と有意に高
かった。
先進医療
・ 試験名:子宮内膜受容能検査(ERA)の有用性確認のための前向き研究
(多施設合同研究)
・ 試験デザイン:多施設前向き試験
・ 期間:2022年4月~2024年3月末
・ 被験者数:400例
・ 主要評価項目:ERA検査結果(Receptive/non-Receptive)および検出率、
ERA検査結果判明後の直近の胚移植あたり妊娠率、ERA実施後の症例あたり
累積妊娠率、妊娠継続率、流産率、出生率
・ 副次評価項目:移植回数、採卵時及び移植時年齢、移植胚等
・試験名:AMED成育疾患克服等総合研究事業
「卵子活性化・タイムラプス・ERAの有効性・安全性検証による生殖補助医療のエビデンス創出」
・試験デザイン:前方視的コホート多施設共同研究
・期間:2022年4月~2024年3月
・被験者数:ERA施行例 50例、対照群(非施行例)≧50例
・主要評価項目:胚移植あたりの生産率
・副次評価項目:胚移植あたりの着床率、臨床的妊娠率
当該先進医療における
選択基準:対象は以下の条件を満たす症例とする。
・42歳以下の女性
・Gardner分類で良好胚(4BB以上)をホルモン補充周期で
凍結融解胚移植する症例
・過去に胚移植(新鮮胚移植、凍結胚移植を問わず)を行い、
2回以上連続して妊娠反応が得られない症例
除外基準:以下のいずれかに該当する症例は除外する。
1)重篤な合併症を有する症例
2)子宮因子(子宮奇形、粘膜下筋腫)症例
3)抗リン脂質抗体検査で異常がある症例
4)夫婦いずれかに染色体検査で異常がある症例
5)精巣内精子回収術によって得た精子を使用している症例
6)その他、研究担当医師が適切ではないと判断した症例
予想される有害事象:術後出血、子宮内感染、非常に稀に子宮穿孔
分析性能試験
薬
事
承
認
申
請
多施設共同研究
A genomic diagnostic tool for human endometrial receptivity based on the
transcriptomic signature. Fertil Steril. 2011 Jan;95(1):50-60, 60.e1-15.
・子宮内膜胚受容能の検出精度
・子宮内膜胚受容能検出プログラムの正常稼働
欧米での現状
薬事承認:米国(無) 欧州(無) 進行中の臨床試験(有)
米国生殖医学会(ASRM)及び欧州生殖医学会(ESHRE)のガイドラインにお
ける記載なし。
※ 本邦の生殖医療ガイドラインにおいては、推奨度Cと評価がされている。
9
※令和4年2月3日開催の第107回先進医療会議の資料から修正
先進医療技術名:子宮内膜胚受容能検査(ERA)
試験薬または試験機器:子宮内膜胚受容能検査プログラムシステム(仮称)
先進医療での適応疾患:胚移植を受ける不妊症患者(これまで反復して着床・妊娠に至らないものに限る)
臨床研究
・ 試験名・試験デザイン:
5-year multicentre
randomized controlled trial
comparing personalized,
frozen and fresh blastocyst
transfer in IVF
3群比較試験
・期間:2013~2017
・被験者数:569
・ 結果の概要:初回に胚盤
胞移植を行った患者を、ERA
によるPET誘導、FET、新鮮胚
移植に無作為割付し、ERAに
よるPET誘導群における累積
妊娠率が93.6%と有意に高
かった。
先進医療
・ 試験名:子宮内膜受容能検査(ERA)の有用性確認のための前向き研究
(多施設合同研究)
・ 試験デザイン:多施設前向き試験
・ 期間:2022年4月~2024年3月末
・ 被験者数:400例
・ 主要評価項目:ERA検査結果(Receptive/non-Receptive)および検出率、
ERA検査結果判明後の直近の胚移植あたり妊娠率、ERA実施後の症例あたり
累積妊娠率、妊娠継続率、流産率、出生率
・ 副次評価項目:移植回数、採卵時及び移植時年齢、移植胚等
・試験名:AMED成育疾患克服等総合研究事業
「卵子活性化・タイムラプス・ERAの有効性・安全性検証による生殖補助医療のエビデンス創出」
・試験デザイン:前方視的コホート多施設共同研究
・期間:2022年4月~2024年3月
・被験者数:ERA施行例 50例、対照群(非施行例)≧50例
・主要評価項目:胚移植あたりの生産率
・副次評価項目:胚移植あたりの着床率、臨床的妊娠率
当該先進医療における
選択基準:対象は以下の条件を満たす症例とする。
・42歳以下の女性
・Gardner分類で良好胚(4BB以上)をホルモン補充周期で
凍結融解胚移植する症例
・過去に胚移植(新鮮胚移植、凍結胚移植を問わず)を行い、
2回以上連続して妊娠反応が得られない症例
除外基準:以下のいずれかに該当する症例は除外する。
1)重篤な合併症を有する症例
2)子宮因子(子宮奇形、粘膜下筋腫)症例
3)抗リン脂質抗体検査で異常がある症例
4)夫婦いずれかに染色体検査で異常がある症例
5)精巣内精子回収術によって得た精子を使用している症例
6)その他、研究担当医師が適切ではないと判断した症例
予想される有害事象:術後出血、子宮内感染、非常に稀に子宮穿孔
分析性能試験
薬
事
承
認
申
請
多施設共同研究
A genomic diagnostic tool for human endometrial receptivity based on the
transcriptomic signature. Fertil Steril. 2011 Jan;95(1):50-60, 60.e1-15.
・子宮内膜胚受容能の検出精度
・子宮内膜胚受容能検出プログラムの正常稼働
欧米での現状
薬事承認:米国(無) 欧州(無) 進行中の臨床試験(有)
米国生殖医学会(ASRM)及び欧州生殖医学会(ESHRE)のガイドラインにお
ける記載なし。
※ 本邦の生殖医療ガイドラインにおいては、推奨度Cと評価がされている。
9
※令和4年2月3日開催の第107回先進医療会議の資料から修正