よむ、つかう、まなぶ。
資料1-1:臨床研究法改正について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
再生医療等の安全性の確保等に関する法律及び臨床研究法
の一部を改正する法律の概要
改正の趣旨
昨今の技術革新等を踏まえ、先端的な医療技術の研究及び安全な提供の基盤を整備し、その更なる推進を図るため、
再生医療等安全性確保法の対象拡大及び再生医療等の提供基盤の整備、臨床研究法の特定臨床研究等の範囲の見直し等
の措置を講ずる。
改正の概要
1.再生医療等安全性確保法の対象拡大及び再生医療等の提供基盤の整備【再生医療等安全性確保法】
①
細胞加工物を用いない遺伝子治療(※1)等は、現在対象となっている細胞加工物(※2)を用いる再生医療等と同様に感染症の伝播
等のリスクがあるため、対象に追加して提供基準の遵守等を義務付けることで、迅速かつ安全な提供及び普及の促進を図る。
※1 細胞加工物を用いない遺伝子治療:人の疾病の治療を目的として、人の体内で遺伝子の導入や改変を行うこと。
※2 細胞加工物:人又は動物の細胞に培養等の加工を行ったもの。
②
再生医療等の提供計画を審査する厚生労働大臣の認定を受けた委員会(認定再生医療等委員会)の設置者に関する立入検査や欠格事
由の規定を整備することにより、審査の公正な実施を確保し、再生医療等の提供基盤を整備する。
2.臨床研究法の特定臨床研究等の範囲の見直し等【臨床研究法、再生医療等安全性確保法】
①
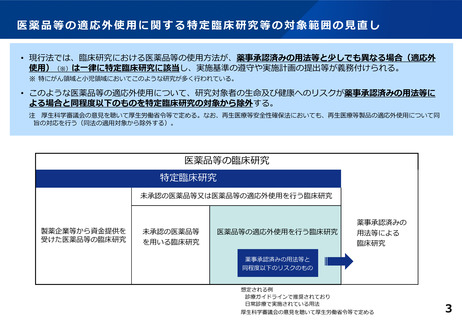
医薬品等の適応外使用(※3)について、薬事承認済みの用法等による場合とリスクが同程度以下の場合には臨床研究法の特定臨床
研究及び再生医療等安全性確保法の再生医療等から除外することにより、研究等の円滑な実施を推進する。
※3 薬事承認された医薬品等を承認された用法等と異なる用法等で使用すること(がんや小児領域の研究に多い。)
②
通常の医療の提供として使用された医薬品等の有効性等について研究する目的で、研究対象者に著しい負担を与える検査等を行う場
合は、その研究について、臨床研究法の対象となる旨を明確化することにより、研究対象者の適切な保護を図る。
等
施行期日
公布の日(令和6年6月14日)から起算して1年以内において政令で定める日
2
の一部を改正する法律の概要
改正の趣旨
昨今の技術革新等を踏まえ、先端的な医療技術の研究及び安全な提供の基盤を整備し、その更なる推進を図るため、
再生医療等安全性確保法の対象拡大及び再生医療等の提供基盤の整備、臨床研究法の特定臨床研究等の範囲の見直し等
の措置を講ずる。
改正の概要
1.再生医療等安全性確保法の対象拡大及び再生医療等の提供基盤の整備【再生医療等安全性確保法】
①
細胞加工物を用いない遺伝子治療(※1)等は、現在対象となっている細胞加工物(※2)を用いる再生医療等と同様に感染症の伝播
等のリスクがあるため、対象に追加して提供基準の遵守等を義務付けることで、迅速かつ安全な提供及び普及の促進を図る。
※1 細胞加工物を用いない遺伝子治療:人の疾病の治療を目的として、人の体内で遺伝子の導入や改変を行うこと。
※2 細胞加工物:人又は動物の細胞に培養等の加工を行ったもの。
②
再生医療等の提供計画を審査する厚生労働大臣の認定を受けた委員会(認定再生医療等委員会)の設置者に関する立入検査や欠格事
由の規定を整備することにより、審査の公正な実施を確保し、再生医療等の提供基盤を整備する。
2.臨床研究法の特定臨床研究等の範囲の見直し等【臨床研究法、再生医療等安全性確保法】
①
医薬品等の適応外使用(※3)について、薬事承認済みの用法等による場合とリスクが同程度以下の場合には臨床研究法の特定臨床
研究及び再生医療等安全性確保法の再生医療等から除外することにより、研究等の円滑な実施を推進する。
※3 薬事承認された医薬品等を承認された用法等と異なる用法等で使用すること(がんや小児領域の研究に多い。)
②
通常の医療の提供として使用された医薬品等の有効性等について研究する目的で、研究対象者に著しい負担を与える検査等を行う場
合は、その研究について、臨床研究法の対象となる旨を明確化することにより、研究対象者の適切な保護を図る。
等
施行期日
公布の日(令和6年6月14日)から起算して1年以内において政令で定める日
2