よむ、つかう、まなぶ。
資料1-1:臨床研究法改正について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
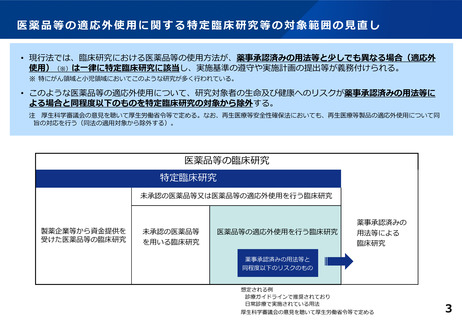
医薬品等の適応外使用に関する特定臨床研究等の対象範囲の見直し
• 現行法では、臨床研究における医薬品等の使用方法が、薬事承認済みの用法等と少しでも異なる場合(適応外
使用)(※)は一律に特定臨床研究に該当し、実施基準の遵守や実施計画の提出等が義務付けられる。
※ 特にがん領域と小児領域においてこのような研究が多く行われている。
• このような医薬品等の適応外使用について、研究対象者の生命及び健康へのリスクが薬事承認済みの用法等に
よる場合と同程度以下のものを特定臨床研究の対象から除外する。
注 厚生科学審議会の意見を聴いて厚生労働省令等で定める。なお、再生医療等安全性確保法においても、再生医療等製品の適応外使用について同
旨の対応を行う(同法の適用対象から除外する)。
医薬品等の臨床研究
特定臨床研究
未承認の医薬品等又は医薬品等の適応外使用を行う臨床研究
製薬企業等から資金提供を
受けた医薬品等の臨床研究
未承認の医薬品等
を用いる臨床研究
医薬品等の適応外使用を行う臨床研究
薬事承認済みの
用法等による
臨床研究
薬事承認済みの用法等と
同程度以下のリスクのもの
想定される例
診療ガイドラインで推奨されており
日常診療で実施されている用法
厚生科学審議会の意見を聴いて厚生労働省令等で定める
3
• 現行法では、臨床研究における医薬品等の使用方法が、薬事承認済みの用法等と少しでも異なる場合(適応外
使用)(※)は一律に特定臨床研究に該当し、実施基準の遵守や実施計画の提出等が義務付けられる。
※ 特にがん領域と小児領域においてこのような研究が多く行われている。
• このような医薬品等の適応外使用について、研究対象者の生命及び健康へのリスクが薬事承認済みの用法等に
よる場合と同程度以下のものを特定臨床研究の対象から除外する。
注 厚生科学審議会の意見を聴いて厚生労働省令等で定める。なお、再生医療等安全性確保法においても、再生医療等製品の適応外使用について同
旨の対応を行う(同法の適用対象から除外する)。
医薬品等の臨床研究
特定臨床研究
未承認の医薬品等又は医薬品等の適応外使用を行う臨床研究
製薬企業等から資金提供を
受けた医薬品等の臨床研究
未承認の医薬品等
を用いる臨床研究
医薬品等の適応外使用を行う臨床研究
薬事承認済みの
用法等による
臨床研究
薬事承認済みの用法等と
同程度以下のリスクのもの
想定される例
診療ガイドラインで推奨されており
日常診療で実施されている用法
厚生科学審議会の意見を聴いて厚生労働省令等で定める
3