よむ、つかう、まなぶ。
資料1-1:臨床研究法改正について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
研究目的で研究対象者に著しい負担を与える検査等を伴う研究に関する法の適用
• 研究目的ではなく、通常の医療の提供として使用された医薬品等の有効性又は安全性を明らかにするために実施する研究がある。
• 通常の医療の提供に追加して研究目的で医薬品等を使用しない場合であっても、研究目的で研究対象者に著しい負担を与え
る検査等を行う場合は、研究対象者の生命・身体の安全が脅かされる可能性があるため、研究目的で医薬品等を使用する場合
と同様に、臨床研究法の対象となる旨を条文上明確化する。
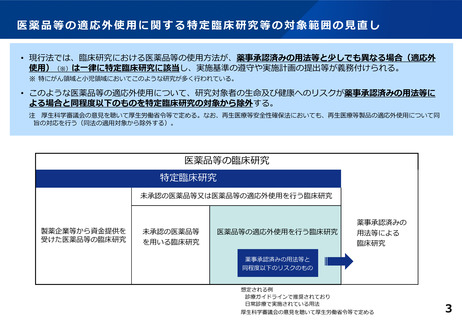
【改正後の臨床研究法の対象範囲】
医薬品等の使用
1.研究目的で医薬品等を使用する場合
検査等
(内容問わず)
研究目的で研究対象者に著しい負担を与える
検査等を通常の医療に追加して行う場合
2.通常の医療の提供として医薬品等を使用す
る場合
例:骨髄穿刺、造影剤を使用するCT検査など
臨床研究法の
対象か否か
対象
対象
(厚生科学審議会の意見を聴いて厚生労働省令等で定める)
上記以外の検査等を通常の医療に追加して行
う場合
対象外
通常の医療に必要な範囲の検査等のみ
(研究目的の検査等は行わない)
対象外
4
• 研究目的ではなく、通常の医療の提供として使用された医薬品等の有効性又は安全性を明らかにするために実施する研究がある。
• 通常の医療の提供に追加して研究目的で医薬品等を使用しない場合であっても、研究目的で研究対象者に著しい負担を与え
る検査等を行う場合は、研究対象者の生命・身体の安全が脅かされる可能性があるため、研究目的で医薬品等を使用する場合
と同様に、臨床研究法の対象となる旨を条文上明確化する。
【改正後の臨床研究法の対象範囲】
医薬品等の使用
1.研究目的で医薬品等を使用する場合
検査等
(内容問わず)
研究目的で研究対象者に著しい負担を与える
検査等を通常の医療に追加して行う場合
2.通常の医療の提供として医薬品等を使用す
る場合
例:骨髄穿刺、造影剤を使用するCT検査など
臨床研究法の
対象か否か
対象
対象
(厚生科学審議会の意見を聴いて厚生労働省令等で定める)
上記以外の検査等を通常の医療に追加して行
う場合
対象外
通常の医療に必要な範囲の検査等のみ
(研究目的の検査等は行わない)
対象外
4