よむ、つかう、まなぶ。
資料1-1:臨床研究法改正について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
臨床研究法(抄)(令和6年法律第51号による改正) (令和6年6月14日公布)
研究目的で著しい負担を与える検査等を行う研究
(定義)
第二条 この法律において「臨床研究」とは、医薬品等を人に対して用いることにより、当該医薬品等の有効性又は安
全性を明らかにする研究(当該研究のうち、当該医薬品等の有効性又は安全性についての試験が、医薬品、医療機器
等の品質、有効性及び安全性の確保等に関する法律(昭和三十五年法律第百四十五号。以下この条において「医薬品
医療機器等法」という。)第八十条の二第二項に規定する治験に該当するものその他厚生労働省令で定めるものを除
き、当該医薬品等を人の疾病の診断、治療若しくは予防のため又は人の身体の構造若しくは機能に影響
を及ぼすために用いる場合において、当該医薬品等の有効性又は安全性を明らかにするために追加的に
必要となる検査その他の行為(当該人の心身に著しい負担を与えるものとして厚生労働省令で定めるも
のに限る。)を行うものを含む。)をいう。
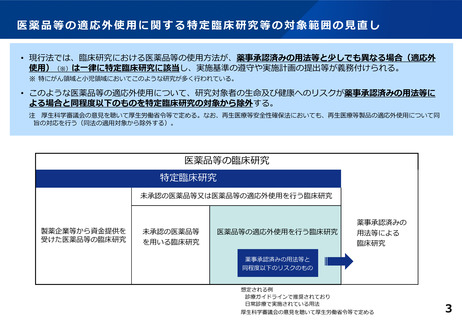
2 この法律において「特定臨床研究」とは、臨床研究のうち、次のいずれかに該当するものをいう。
一 (略)
研究対象者の生命及び健康へのリスクが薬事承認済み
二 次に掲げる医薬品等を用いる臨床研究(前号に該当するものを除く。)
の用法等による場合と同程度以下の適応外使用
イ (略)
ロ 次項第一号に掲げる医薬品であって、医薬品医療機器等法第十四条第一項又は第十九条の二第一項の承認(医
薬品医療機器等法第十四条第十五項(医薬品医療機器等法第十九条の二第五項において準用する場合を含む。)
の変更の承認を含む。以下ロにおいて同じ。)を受けているもの(当該承認に係る用法、用量、効能及び
効果(以下ロにおいて「用法等」という。)と異なる用法等(人の生命及び健康に影響を与えるお
それが当該承認に係る用法等と同程度以下のものとして厚生労働省令で定める用法等を除く。)で
用いる場合に限る。)
以下、二で医療機器について、へで再生医療等製品について同様に改正
審議会の意見を聴いて厚生労働省令で定める
(厚生科学審議会の意見の聴取)
第三十五条の二 厚生労働大臣は、次に掲げる場合には、あらかじめ、厚生科学審議会の意見を聴かなければならない。
一 第二条第一項の検査その他の行為を定める厚生労働省令又は同条第二項第二号ロ、ニ若しくはヘの厚生労働省令
を制定し、又は改廃しようとするとき。
5
二 臨床研究実施基準を定め、又は変更しようとするとき。
研究目的で著しい負担を与える検査等を行う研究
(定義)
第二条 この法律において「臨床研究」とは、医薬品等を人に対して用いることにより、当該医薬品等の有効性又は安
全性を明らかにする研究(当該研究のうち、当該医薬品等の有効性又は安全性についての試験が、医薬品、医療機器
等の品質、有効性及び安全性の確保等に関する法律(昭和三十五年法律第百四十五号。以下この条において「医薬品
医療機器等法」という。)第八十条の二第二項に規定する治験に該当するものその他厚生労働省令で定めるものを除
き、当該医薬品等を人の疾病の診断、治療若しくは予防のため又は人の身体の構造若しくは機能に影響
を及ぼすために用いる場合において、当該医薬品等の有効性又は安全性を明らかにするために追加的に
必要となる検査その他の行為(当該人の心身に著しい負担を与えるものとして厚生労働省令で定めるも
のに限る。)を行うものを含む。)をいう。
2 この法律において「特定臨床研究」とは、臨床研究のうち、次のいずれかに該当するものをいう。
一 (略)
研究対象者の生命及び健康へのリスクが薬事承認済み
二 次に掲げる医薬品等を用いる臨床研究(前号に該当するものを除く。)
の用法等による場合と同程度以下の適応外使用
イ (略)
ロ 次項第一号に掲げる医薬品であって、医薬品医療機器等法第十四条第一項又は第十九条の二第一項の承認(医
薬品医療機器等法第十四条第十五項(医薬品医療機器等法第十九条の二第五項において準用する場合を含む。)
の変更の承認を含む。以下ロにおいて同じ。)を受けているもの(当該承認に係る用法、用量、効能及び
効果(以下ロにおいて「用法等」という。)と異なる用法等(人の生命及び健康に影響を与えるお
それが当該承認に係る用法等と同程度以下のものとして厚生労働省令で定める用法等を除く。)で
用いる場合に限る。)
以下、二で医療機器について、へで再生医療等製品について同様に改正
審議会の意見を聴いて厚生労働省令で定める
(厚生科学審議会の意見の聴取)
第三十五条の二 厚生労働大臣は、次に掲げる場合には、あらかじめ、厚生科学審議会の意見を聴かなければならない。
一 第二条第一項の検査その他の行為を定める厚生労働省令又は同条第二項第二号ロ、ニ若しくはヘの厚生労働省令
を制定し、又は改廃しようとするとき。
5
二 臨床研究実施基準を定め、又は変更しようとするとき。