よむ、つかう、まなぶ。
資料2-1:適応外使用に関する特定臨床研究の対象範囲について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
一定の臨床研究の特定臨床研究の対象からの除外に関する
運用方法、基準(案)
第35回
臨床研究部会
令和6年8月8日
資料1-2
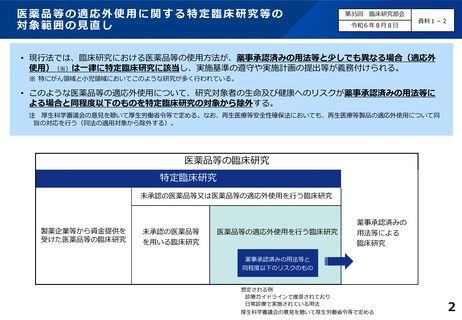
○ 特定臨床研究から一定の臨床研究を除外する仕組みの運用に当たっては、国が省令及び通知
において明確な基準や事例等を示した上で、これらに基づき、CRBにおいて判断する仕組み
としてはどうか。
○ この基準は、
• 診療ガイドラインに掲載されている用法等や、それと同等の有効性及び安全性のエビデン
スが収集され、レビューにより推奨されることが明確である用法等は除外する
• 用法・用量のみが適応外(例:減量プロトコール)であり、研究対象者に対して、有効か
つ安全であると判断される場合も除外する
• 日常診療で問題なく使用できている実績及び予期せぬ重大な副作用が多く発生していない
ことを担保する
こととしてはどうか。
※ 医療機器、再生医療等製品についても同基準とする。
○ また、改正法施行後1年間の本改正内容の施行状況(件数、内容等)について臨床研究部会
において確認することとし、課題等を整理してはどうか。
4
運用方法、基準(案)
第35回
臨床研究部会
令和6年8月8日
資料1-2
○ 特定臨床研究から一定の臨床研究を除外する仕組みの運用に当たっては、国が省令及び通知
において明確な基準や事例等を示した上で、これらに基づき、CRBにおいて判断する仕組み
としてはどうか。
○ この基準は、
• 診療ガイドラインに掲載されている用法等や、それと同等の有効性及び安全性のエビデン
スが収集され、レビューにより推奨されることが明確である用法等は除外する
• 用法・用量のみが適応外(例:減量プロトコール)であり、研究対象者に対して、有効か
つ安全であると判断される場合も除外する
• 日常診療で問題なく使用できている実績及び予期せぬ重大な副作用が多く発生していない
ことを担保する
こととしてはどうか。
※ 医療機器、再生医療等製品についても同基準とする。
○ また、改正法施行後1年間の本改正内容の施行状況(件数、内容等)について臨床研究部会
において確認することとし、課題等を整理してはどうか。
4