よむ、つかう、まなぶ。
総-6参考4[479KB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.臨床成績
切除不能な胞巣状軟部肉腫の承認時に評価を行った主な臨床試験の成績を示す。
【有効性】
① 海外第Ⅱ相臨床試験(ML39345 試験)
2 歳以上の切除不能な胞巣状軟部肉腫患者*150 例を対象に、本剤の有効性及び安全
性を検討する第Ⅱ相試験を実施した。18 歳以上の患者には本剤 1,200 mg を 3 週間間
隔(以下、
「Q3W」という。
)で、2 歳以上 18 歳未満の患者には本剤 15 mg/kg(最大
1,200 mg)を Q3W で静脈内投与した。
本試験に登録された 50 例のうち、本剤が投与されなかった 1 例を除く 49 例*2 を有効
性の解析対象とした。試験開始時点での主要評価項目である RECIST ver.1.1 に基づく治
験担当医師判定による奏効率[80%信頼区間]
(%)の結果は、2 回目の解析(19 例時点)
で 42.1[26.3, 59.2]であり、80%信頼区間の下限は事前に規定した閾値奏効率(5%)を
上回った*3。なお、有効性の解析対象である 49 例における 3 回目の解析(2021 年 9 月
1 日データカットオフ)における試験開始後に変更した主要評価項目である RECIST
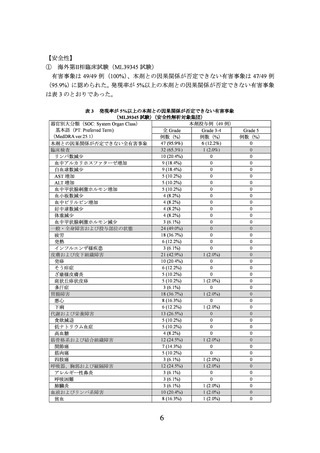
ver.1.1 に基づく独立評価機関(以下、「IRC」という。)判定による奏効率の結果は表 1
のとおりであった*4。
*1:抗 PD-1 抗体又は抗 PD-L1 抗体による治療歴のある患者は除外された。
*2:年齢区分別の内訳は、18 歳未満:3 例、18 歳以上:46 例であった。
*3:Simon の 2 段階デザインに基づき、試験開始時には 1 回目及び 2 回目の解析はそれぞれ 9 例及び
24 例時点で実施し、それぞれ 1 例以上及び 3 例以上で奏効が認められた場合に、登録を継続する
と計画した。9 例の評価が完了した時点での 1 回目の解析において 1 例の奏効例が認められたた
め、登録を継続した。その後、19 例の評価が完了した時点で事前に計画していなかった 2 回目の
解析を実施し、8 例の奏効例が認められたことから、事前に規定した 2 回目の解析における症例
数である 24 例の集積を待たずに、閾値奏効率以上の有効性が期待できると判断し、更なる有効
性評価のために登録を継続した。
*4:本試験の主要評価項目は、試験開始時には RECIST ver.1.1 に基づく治験担当医師判定による奏効
率としたが、1 回目及び 2 回目の解析を実施した後、海外規制当局との相談の結果を踏まえ、
RECIST ver.1.1 に基づく IRC 判定による奏効率に変更した。また、海外規制当局との相談の結果、
49 例の結果に基づき事前に計画していなかった 3 回目の解析を実施した。
4
切除不能な胞巣状軟部肉腫の承認時に評価を行った主な臨床試験の成績を示す。
【有効性】
① 海外第Ⅱ相臨床試験(ML39345 試験)
2 歳以上の切除不能な胞巣状軟部肉腫患者*150 例を対象に、本剤の有効性及び安全
性を検討する第Ⅱ相試験を実施した。18 歳以上の患者には本剤 1,200 mg を 3 週間間
隔(以下、
「Q3W」という。
)で、2 歳以上 18 歳未満の患者には本剤 15 mg/kg(最大
1,200 mg)を Q3W で静脈内投与した。
本試験に登録された 50 例のうち、本剤が投与されなかった 1 例を除く 49 例*2 を有効
性の解析対象とした。試験開始時点での主要評価項目である RECIST ver.1.1 に基づく治
験担当医師判定による奏効率[80%信頼区間]
(%)の結果は、2 回目の解析(19 例時点)
で 42.1[26.3, 59.2]であり、80%信頼区間の下限は事前に規定した閾値奏効率(5%)を
上回った*3。なお、有効性の解析対象である 49 例における 3 回目の解析(2021 年 9 月
1 日データカットオフ)における試験開始後に変更した主要評価項目である RECIST
ver.1.1 に基づく独立評価機関(以下、「IRC」という。)判定による奏効率の結果は表 1
のとおりであった*4。
*1:抗 PD-1 抗体又は抗 PD-L1 抗体による治療歴のある患者は除外された。
*2:年齢区分別の内訳は、18 歳未満:3 例、18 歳以上:46 例であった。
*3:Simon の 2 段階デザインに基づき、試験開始時には 1 回目及び 2 回目の解析はそれぞれ 9 例及び
24 例時点で実施し、それぞれ 1 例以上及び 3 例以上で奏効が認められた場合に、登録を継続する
と計画した。9 例の評価が完了した時点での 1 回目の解析において 1 例の奏効例が認められたた
め、登録を継続した。その後、19 例の評価が完了した時点で事前に計画していなかった 2 回目の
解析を実施し、8 例の奏効例が認められたことから、事前に規定した 2 回目の解析における症例
数である 24 例の集積を待たずに、閾値奏効率以上の有効性が期待できると判断し、更なる有効
性評価のために登録を継続した。
*4:本試験の主要評価項目は、試験開始時には RECIST ver.1.1 に基づく治験担当医師判定による奏効
率としたが、1 回目及び 2 回目の解析を実施した後、海外規制当局との相談の結果を踏まえ、
RECIST ver.1.1 に基づく IRC 判定による奏効率に変更した。また、海外規制当局との相談の結果、
49 例の結果に基づき事前に計画していなかった 3 回目の解析を実施した。
4