よむ、つかう、まなぶ。
総-6参考4[479KB] (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53715.html |
| 出典情報 | 中央社会保険医療協議会 総会(第605回 3/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
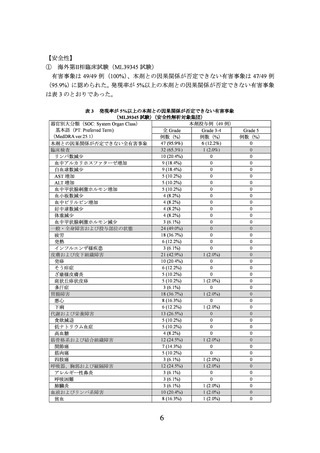
器官別大分類(SOC: System Organ Class)
基本語(PT: Preferred Term)
(MedDRA ver.25.1)
貧血
一般・全身障害および投与部位の状態
発熱
倦怠感
内分泌障害
バセドウ病
甲状腺炎
甲状腺機能低下症
甲状腺機能亢進症
胃腸障害
悪心
嘔吐
筋骨格系および結合組織障害
筋肉痛
関節痛
代謝および栄養障害
高尿酸血症
低カリウム血症
感染症および寄生虫症
耳下腺炎
肝胆道系障害
肝機能異常
呼吸器、胸郭および縦隔障害
口腔咽頭痛
肺臓炎
心臓障害
洞性徐脈
神経系障害
頭痛
腎および尿路障害
血尿
蛋白尿
全 Grade
例数(%)
3 (15.0%)
3 (15.0%)
3 (15.0%)
1 (5.0%)
3 (15.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
2 (10.0%)
1 (5.0%)
1 (5.0%)
2 (10.0%)
2 (10.0%)
1 (5.0%)
2 (10.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
単群(20 例)
Grade 3-4
例数(%)
0
0
0
0
1 (5.0%)
0
1 (5.0%)
0
0
0
0
0
0
0
0
0
0
0
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
0
0
0
0
0
0
0
0
0
0
Grade 5
例数(%)
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
なお、本剤投与例において間質性肺疾患 1 例(5.0%)
、肝機能障害・肝炎・硬化性胆
管炎 6 例(30.0%)、甲状腺機能障害 3 例(15.0%)
、副腎機能障害 1 例(5.0%)が認めら
れた。また、大腸炎・重度の下痢、膵炎、1 型糖尿病、下垂体機能障害、脳炎・髄膜炎・
脊髄炎、神経障害(ギラン・バレー症候群を含む)、重症筋無力症、重度の皮膚障害、
腎機能障害(尿細管間質性腎炎等)、筋炎・横紋筋融解症、心筋炎、血球貪食症候群、
infusion reaction、溶血性貧血、免疫性血小板減少性紫斑病及び心膜炎・心嚢液貯留・心
タンポナーデは認められなかった。本副作用発現状況は関連事象(臨床検査値異常を含
む)を含む集計結果を示す。
8
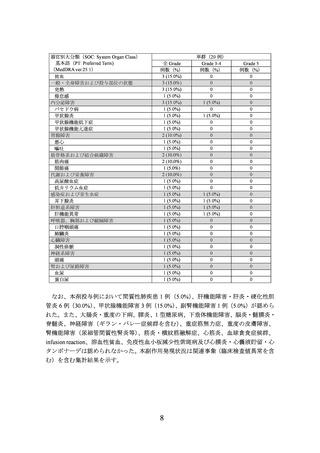
基本語(PT: Preferred Term)
(MedDRA ver.25.1)
貧血
一般・全身障害および投与部位の状態
発熱
倦怠感
内分泌障害
バセドウ病
甲状腺炎
甲状腺機能低下症
甲状腺機能亢進症
胃腸障害
悪心
嘔吐
筋骨格系および結合組織障害
筋肉痛
関節痛
代謝および栄養障害
高尿酸血症
低カリウム血症
感染症および寄生虫症
耳下腺炎
肝胆道系障害
肝機能異常
呼吸器、胸郭および縦隔障害
口腔咽頭痛
肺臓炎
心臓障害
洞性徐脈
神経系障害
頭痛
腎および尿路障害
血尿
蛋白尿
全 Grade
例数(%)
3 (15.0%)
3 (15.0%)
3 (15.0%)
1 (5.0%)
3 (15.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
2 (10.0%)
1 (5.0%)
1 (5.0%)
2 (10.0%)
2 (10.0%)
1 (5.0%)
2 (10.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
単群(20 例)
Grade 3-4
例数(%)
0
0
0
0
1 (5.0%)
0
1 (5.0%)
0
0
0
0
0
0
0
0
0
0
0
1 (5.0%)
1 (5.0%)
1 (5.0%)
1 (5.0%)
0
0
0
0
0
0
0
0
0
0
Grade 5
例数(%)
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
なお、本剤投与例において間質性肺疾患 1 例(5.0%)
、肝機能障害・肝炎・硬化性胆
管炎 6 例(30.0%)、甲状腺機能障害 3 例(15.0%)
、副腎機能障害 1 例(5.0%)が認めら
れた。また、大腸炎・重度の下痢、膵炎、1 型糖尿病、下垂体機能障害、脳炎・髄膜炎・
脊髄炎、神経障害(ギラン・バレー症候群を含む)、重症筋無力症、重度の皮膚障害、
腎機能障害(尿細管間質性腎炎等)、筋炎・横紋筋融解症、心筋炎、血球貪食症候群、
infusion reaction、溶血性貧血、免疫性血小板減少性紫斑病及び心膜炎・心嚢液貯留・心
タンポナーデは認められなかった。本副作用発現状況は関連事象(臨床検査値異常を含
む)を含む集計結果を示す。
8