よむ、つかう、まなぶ。
資料3-2 先進医療B評価表(整理番号127) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25542.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第133回 5/19)《厚生労働省》 |
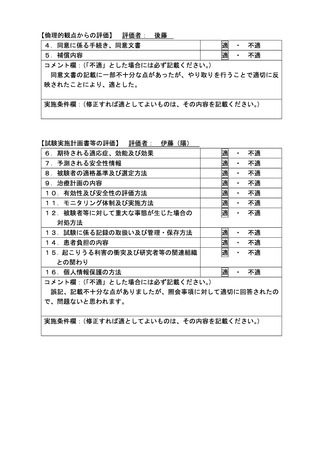
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
申請者らは、過去の観察研究の結果から精神症状を伴う更年期障害に対して有
効であることを解明したと述べているが、引用されている論文は、cross sectional
な研究により、ホットフラッシュやうつ症状に関して、ビタミン B6 の摂取との逆
相関を示しているに過ぎず、かならずしも因果関係を証明したものではない。ま
た、オッズ比も、 いずれの症状に対しても 0.9 前後、信頼区間の上限も 1.0 をぎ
りぎりに下回っているに過ぎない。臨床上のエビデンスレベルとしては高くはな
い。前向きの試験としては、カルボニルストレスを有する統合失調症患者を対象と
した第2相臨床試験があるが、試験デザインのリミテーション、すなわちオープン
ラベルの用量漸増試験デザインであったこともあり、ピリドキサミンの臨床的有
効性は示されていないと考える(論文の論調とは異なる個人意見)。
非臨床試験での安全性の検討については、比較的リッチな毒性試験のパッケー
ジとなっており、臨床試験を開始するための充足性という意味では十分に検討さ
れているように見える。一方で、それぞれの毒性試験におけるトキシコキネティッ
クスデータの具体的な数字は開示されておらず、今回の臨床試験で到達する予定
の臨床暴露量との間の安全マージンについて議論することができない。このこと
は、大きな懸念点である。
毒性試験では、様々な臓器(下垂体、甲状腺、肝臓など)に所見がみとめられた。
また、統合失調症の臨床試験においては、10名の患者にピリドキサミンが投与さ
れ、4例に9件の重篤な有害事象(てんかん及び昏迷1例各1件、てんかん及びウ
ェルニッケ脳症1例、てんかん、ウェルニッケ脳症、亞イレウス及び意識消失1例
各1件および肺炎1例)が出現している。また、I 型又は II 型糖尿病に伴う糖尿
病性腎症患者を対象とした第2相試験(海外)においても、実薬投与群(全体で 57
例)のうち3例が死亡している。とくに糖尿病性ケトアシドーシスとそれに続く心
停止、昏睡、気管支肺炎については、
“明らかに関連あり“と評価されている。
(ち
なみに、この死亡例の事象については、同意説明文書の中では一切触れられていな
い。)
臨床試験を実施するためには、非臨床試験およびこれまでの臨床試験のデータ
からすでに明らかになったリスク、あるいは想定されるリスクを同定し、例えば、
患者の組み入れ基準、あるいは除外基準が医学的に適切かどうか、仮に有害事象が
でた場合の体制は十分であるかなど考慮したリスクマネジメントプランが必須と
なる。実施体制の面でも、早期開発に精通した臨床薬理専門医あるいは内科系医師
を医学専門家としてコンサルト可能な研究体制を構築することも重要である。ま
た、この試験では抑うつや不安を評価しようとしており、自殺念慮、自殺企図の評
価もふくめて精神科医に対してコンサルト可能な体制構築も必要であろう。申請
者らは、
「効果判定評価委員会」や CRB の委員に専門家が配置されていると回答し
ているが、安全性の問題が発生した際に迅速に対応するためには、少なくとも、研
究組織の中にリアルタイムで内科的あるいは精神科的な相談ができる体制を作る
べきであろう。大学病院でそれができないはずがないので、安全性についてはしっ
効であることを解明したと述べているが、引用されている論文は、cross sectional
な研究により、ホットフラッシュやうつ症状に関して、ビタミン B6 の摂取との逆
相関を示しているに過ぎず、かならずしも因果関係を証明したものではない。ま
た、オッズ比も、 いずれの症状に対しても 0.9 前後、信頼区間の上限も 1.0 をぎ
りぎりに下回っているに過ぎない。臨床上のエビデンスレベルとしては高くはな
い。前向きの試験としては、カルボニルストレスを有する統合失調症患者を対象と
した第2相臨床試験があるが、試験デザインのリミテーション、すなわちオープン
ラベルの用量漸増試験デザインであったこともあり、ピリドキサミンの臨床的有
効性は示されていないと考える(論文の論調とは異なる個人意見)。
非臨床試験での安全性の検討については、比較的リッチな毒性試験のパッケー
ジとなっており、臨床試験を開始するための充足性という意味では十分に検討さ
れているように見える。一方で、それぞれの毒性試験におけるトキシコキネティッ
クスデータの具体的な数字は開示されておらず、今回の臨床試験で到達する予定
の臨床暴露量との間の安全マージンについて議論することができない。このこと
は、大きな懸念点である。
毒性試験では、様々な臓器(下垂体、甲状腺、肝臓など)に所見がみとめられた。
また、統合失調症の臨床試験においては、10名の患者にピリドキサミンが投与さ
れ、4例に9件の重篤な有害事象(てんかん及び昏迷1例各1件、てんかん及びウ
ェルニッケ脳症1例、てんかん、ウェルニッケ脳症、亞イレウス及び意識消失1例
各1件および肺炎1例)が出現している。また、I 型又は II 型糖尿病に伴う糖尿
病性腎症患者を対象とした第2相試験(海外)においても、実薬投与群(全体で 57
例)のうち3例が死亡している。とくに糖尿病性ケトアシドーシスとそれに続く心
停止、昏睡、気管支肺炎については、
“明らかに関連あり“と評価されている。
(ち
なみに、この死亡例の事象については、同意説明文書の中では一切触れられていな
い。)
臨床試験を実施するためには、非臨床試験およびこれまでの臨床試験のデータ
からすでに明らかになったリスク、あるいは想定されるリスクを同定し、例えば、
患者の組み入れ基準、あるいは除外基準が医学的に適切かどうか、仮に有害事象が
でた場合の体制は十分であるかなど考慮したリスクマネジメントプランが必須と
なる。実施体制の面でも、早期開発に精通した臨床薬理専門医あるいは内科系医師
を医学専門家としてコンサルト可能な研究体制を構築することも重要である。ま
た、この試験では抑うつや不安を評価しようとしており、自殺念慮、自殺企図の評
価もふくめて精神科医に対してコンサルト可能な体制構築も必要であろう。申請
者らは、
「効果判定評価委員会」や CRB の委員に専門家が配置されていると回答し
ているが、安全性の問題が発生した際に迅速に対応するためには、少なくとも、研
究組織の中にリアルタイムで内科的あるいは精神科的な相談ができる体制を作る
べきであろう。大学病院でそれができないはずがないので、安全性についてはしっ