よむ、つかう、まなぶ。
○1 患者申出療養の中間報告について別紙2 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00020.html |
| 出典情報 | 患者申出療養評価会議(第33回 9/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.概要
臨床研究登録ID:jRCTs031180025, UMIN000023620
目的:腹膜播種陽性または腹腔細胞診陽性の胃癌症例を対象として、S-1+パクリタキセル経静脈・
腹腔内併用療法の安全性と有効性を評価する。
技術の内容:
S-1+パクリタキセル経静脈・腹腔内併用療法は、標準治療である S-1+CDDP 併用療法を対照
とした第Ⅲ相試験において、腹膜播種陽性胃癌に対する有効性が示唆された新規治療法である。
本研究は、患者申出療養制度下に、腹膜播種陽性または腹腔細胞診陽性の胃癌症例を対象として、
本療法の安全性と有効性を評価することを目的とする。審査腹腔鏡により腹膜播種陽性または腹腔
細胞診陽性を確認し、腹腔ポートを留置する。21 日間を 1 コースとして S-1 80 mg/m2/day を 14
日間内服し、7 日間休薬する。第 1, 8 日にパクリタキセル 50 mg/m2 を経静脈投与、20 mg/m2 を腹
腔内投与する。本療法は腫瘍の進行が確認されるか、有害事象により継続困難となるまで反復する。
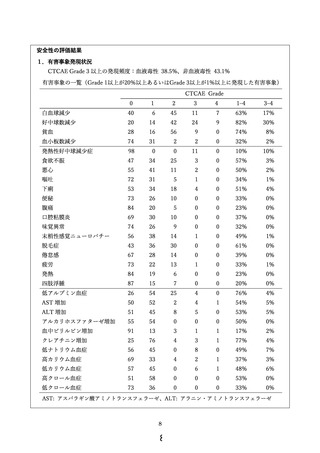
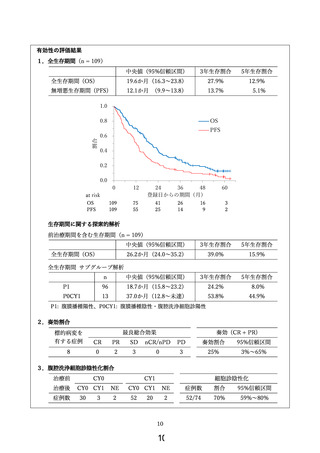
主要評価項目は有害事象発現状況、副次評価項目は全生存期間、奏効割合および腹腔洗浄細胞診
陰性化割合とする。本試験には、先進医療制度下に腹腔内化学療法の臨床試験を実施中の腹腔内化
学療法研究会の施設が参加し、研究期間は6年、登録症例数は 121 例を予定する。
患者数
① 計画時:100 人(特例により 121 例まで追加の症例登録が承認された。)
② 中間報告時:111 人
③ 考察:本研究は 2016 年 10 月に患者申出療養として告示され、東京大学医学部附属病院に
おいて症例登録を開始した。その後協力医療機関の参加が承認され、参加施設は計 21 施設
となった。予定を上回るペースで症例が集積され、2017 年 3 月に 100 例の登録を完了した。
予定症例数の 100 例が本登録された時点で、既に説明、同意取得や仮登録が行われていた症
例があり、特例として 21 例の追加登録が認められた。2017 年 6 月までに追加で 11 例(合
計 111 例)が登録され、試験治療を受けた。その後、腫瘍増悪や有害事象などにより治療が
中止され、2021 年 10 月 14 日時点で 4 例が治療継続中である。
診断及び主要な組入れ基準:
[対象疾患]
腹膜播種陽性または腹腔細胞診陽性の胃癌
[選択基準]
以下の基準を全て満たす症例を対象とする。
1) 組織学的または細胞学的に腺癌であることが確認された胃癌症例
2) 腹膜播種陽性または腹腔細胞診陽性の症例
3) 登録前 14 日以内の検査により以下の骨髄・肝・腎機能を有する症例
4) 好中球数
:1,000/mm3 以上
5) 血色素量
:8.0g/dL 以上
6) 血小板数
:75,000/mm3 以上
2
2
臨床研究登録ID:jRCTs031180025, UMIN000023620
目的:腹膜播種陽性または腹腔細胞診陽性の胃癌症例を対象として、S-1+パクリタキセル経静脈・
腹腔内併用療法の安全性と有効性を評価する。
技術の内容:
S-1+パクリタキセル経静脈・腹腔内併用療法は、標準治療である S-1+CDDP 併用療法を対照
とした第Ⅲ相試験において、腹膜播種陽性胃癌に対する有効性が示唆された新規治療法である。
本研究は、患者申出療養制度下に、腹膜播種陽性または腹腔細胞診陽性の胃癌症例を対象として、
本療法の安全性と有効性を評価することを目的とする。審査腹腔鏡により腹膜播種陽性または腹腔
細胞診陽性を確認し、腹腔ポートを留置する。21 日間を 1 コースとして S-1 80 mg/m2/day を 14
日間内服し、7 日間休薬する。第 1, 8 日にパクリタキセル 50 mg/m2 を経静脈投与、20 mg/m2 を腹
腔内投与する。本療法は腫瘍の進行が確認されるか、有害事象により継続困難となるまで反復する。
主要評価項目は有害事象発現状況、副次評価項目は全生存期間、奏効割合および腹腔洗浄細胞診
陰性化割合とする。本試験には、先進医療制度下に腹腔内化学療法の臨床試験を実施中の腹腔内化
学療法研究会の施設が参加し、研究期間は6年、登録症例数は 121 例を予定する。
患者数
① 計画時:100 人(特例により 121 例まで追加の症例登録が承認された。)
② 中間報告時:111 人
③ 考察:本研究は 2016 年 10 月に患者申出療養として告示され、東京大学医学部附属病院に
おいて症例登録を開始した。その後協力医療機関の参加が承認され、参加施設は計 21 施設
となった。予定を上回るペースで症例が集積され、2017 年 3 月に 100 例の登録を完了した。
予定症例数の 100 例が本登録された時点で、既に説明、同意取得や仮登録が行われていた症
例があり、特例として 21 例の追加登録が認められた。2017 年 6 月までに追加で 11 例(合
計 111 例)が登録され、試験治療を受けた。その後、腫瘍増悪や有害事象などにより治療が
中止され、2021 年 10 月 14 日時点で 4 例が治療継続中である。
診断及び主要な組入れ基準:
[対象疾患]
腹膜播種陽性または腹腔細胞診陽性の胃癌
[選択基準]
以下の基準を全て満たす症例を対象とする。
1) 組織学的または細胞学的に腺癌であることが確認された胃癌症例
2) 腹膜播種陽性または腹腔細胞診陽性の症例
3) 登録前 14 日以内の検査により以下の骨髄・肝・腎機能を有する症例
4) 好中球数
:1,000/mm3 以上
5) 血色素量
:8.0g/dL 以上
6) 血小板数
:75,000/mm3 以上
2
2