よむ、つかう、まなぶ。
○1 患者申出療養の中間報告について別紙2 (4 ページ)
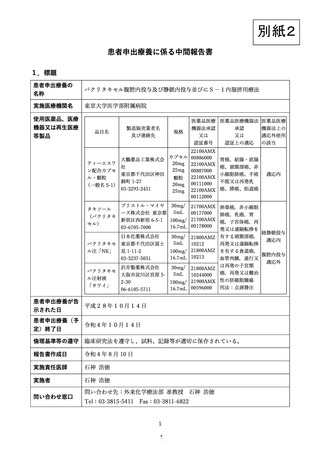
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00020.html |
| 出典情報 | 患者申出療養評価会議(第33回 9/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
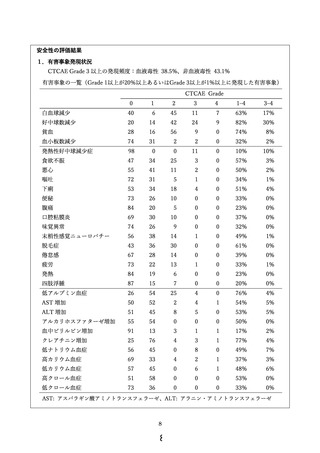
・ 腹膜播種がなく、腹腔細胞診が陰性であった場合は対象外となる。
・ 既に開腹または審査腹腔鏡等により腹膜播種の評価が行われている場合は、審査腹腔鏡を
省略することも可とする。
・ 腹水貯留例において経皮的穿刺が可能な場合は、審査腹腔鏡を省略し、カテーテルを留置し
て腹腔内投与を行う方法も可とする。
症例登録方法
症例登録は大学病院臨床試験アライアンスの臨床研究支援システム UHCT ACReSS を用い
て行う。その手順は下記の通りとする。
・参加施設の担当医師は適格性を確認の上、症例登録票に必要事項を入力して送信する。
・データセンターの担当者は症例登録票の入力内容を確認し、不備や不明な点があった場合は
担当医師または研究責任医師に問い合わせる。症例登録票の確認が完了した時点で、データ
センターより担当医師および研究責任医師に登録完了の通知を送付する。
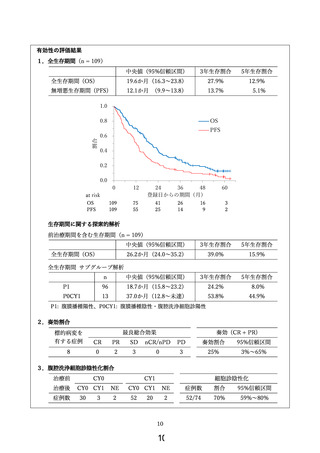
本研究は、実施計画書「13.研究実施期間」に記載の期間実施する。研究の終了時に主要評価
項目および副次評価項目の評価を行う。
3. 被験者の試験参加予定期間
被験者の研究参加期間は有害事象発生状況や治療奏効期間により異なり、6 週間~約6年間
(前観察期間 約 2 週間、試験薬投与期間 1 日~6年間、後観察期間 4 週間)となる。
4. 試験薬の用法・用量、投与期間
4.1. 試験治療の定義
試験治療として S-1+パクリタキセル経静脈・腹腔内併用療法を行う。なお、S-1 または
パクリタキセル経静脈の投与を中止した場合も試験治療とする。
4.2. 投与スケジュール
21 日間を 1 コースとして、S-1 80mg/m2 を 14 日間内服し、7 日間休薬する。
第 1, 8 日にパクリタキセル 50mg/m2 を経静脈投与、20mg/m2 を腹腔内投与する。
パクリタキセル IP
パクリタキセル IV
20mg/m2
50mg/m2
S-1
80mg/m2
↓
↓
↓
↓
1
8
14
21 日
4.3. S-1 の投与
① S-1の初回投与量は下記の基準量とする。
クレアチニンクリアランス (mL/min)
80≦
体表
面積
(m2)
< 1.25
1.25 ≦
< 1.5
1.5 ≦
80mg/日
50 ≦
< 80
30 ≦
< 50
50mg/日
40mg/日
100mg/日
80mg/日
50mg/日
120mg/日
100mg/日
80mg/日
ただし、研究責任医師または分担医師が被験者の安全性確保のため必要と判断した
場合は、適宜減量して投与することも可能とする。
4
4
・ 既に開腹または審査腹腔鏡等により腹膜播種の評価が行われている場合は、審査腹腔鏡を
省略することも可とする。
・ 腹水貯留例において経皮的穿刺が可能な場合は、審査腹腔鏡を省略し、カテーテルを留置し
て腹腔内投与を行う方法も可とする。
症例登録方法
症例登録は大学病院臨床試験アライアンスの臨床研究支援システム UHCT ACReSS を用い
て行う。その手順は下記の通りとする。
・参加施設の担当医師は適格性を確認の上、症例登録票に必要事項を入力して送信する。
・データセンターの担当者は症例登録票の入力内容を確認し、不備や不明な点があった場合は
担当医師または研究責任医師に問い合わせる。症例登録票の確認が完了した時点で、データ
センターより担当医師および研究責任医師に登録完了の通知を送付する。
本研究は、実施計画書「13.研究実施期間」に記載の期間実施する。研究の終了時に主要評価
項目および副次評価項目の評価を行う。
3. 被験者の試験参加予定期間
被験者の研究参加期間は有害事象発生状況や治療奏効期間により異なり、6 週間~約6年間
(前観察期間 約 2 週間、試験薬投与期間 1 日~6年間、後観察期間 4 週間)となる。
4. 試験薬の用法・用量、投与期間
4.1. 試験治療の定義
試験治療として S-1+パクリタキセル経静脈・腹腔内併用療法を行う。なお、S-1 または
パクリタキセル経静脈の投与を中止した場合も試験治療とする。
4.2. 投与スケジュール
21 日間を 1 コースとして、S-1 80mg/m2 を 14 日間内服し、7 日間休薬する。
第 1, 8 日にパクリタキセル 50mg/m2 を経静脈投与、20mg/m2 を腹腔内投与する。
パクリタキセル IP
パクリタキセル IV
20mg/m2
50mg/m2
S-1
80mg/m2
↓
↓
↓
↓
1
8
14
21 日
4.3. S-1 の投与
① S-1の初回投与量は下記の基準量とする。
クレアチニンクリアランス (mL/min)
80≦
体表
面積
(m2)
< 1.25
1.25 ≦
< 1.5
1.5 ≦
80mg/日
50 ≦
< 80
30 ≦
< 50
50mg/日
40mg/日
100mg/日
80mg/日
50mg/日
120mg/日
100mg/日
80mg/日
ただし、研究責任医師または分担医師が被験者の安全性確保のため必要と判断した
場合は、適宜減量して投与することも可能とする。
4
4