よむ、つかう、まなぶ。
参考資料 薬害を学ぼう「指導の手引き」 (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000197733_00005.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 薬害を学び再発を防止するための教育に関する検討会(第21回 1/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【プラス情報】
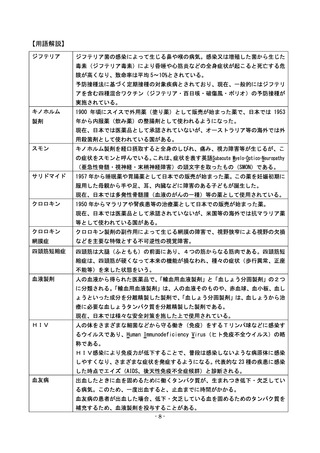
キノホルム製剤によるスモンの発生やサリドマイドによる胎児の障害の発生を受けて
創設された制度の具体的な内容は以下のとおり。
(キノホルム製剤によるスモンの発生 3つ目の■)
■これらをきっかけに、薬の安全性を確保するための法律改
正や薬の副作用で被害を受けた人を救済する制度の創設がな
されました。スモンは、社会の仕組みに影響を与え、国や製
薬会社、医療従事者といった関係者に様々な教訓をもたらし
た薬害です。
薬の副作用で被害を受け
た人に医療費などを支給
する制度を作りました。
・ 薬は承認審査で承認されて初めて市販されますが、市販後一定期間がたった薬について市
販後の状況を踏まえて再度審査を行うようになりました。
[再審査制度]
・ 医学薬学の進歩に伴い、薬の有効性や安全性に変化があり得ることから既存の薬について
再評価の実施を法律に明記しました。
[再評価制度]
・ ウイルスが混入するなど品質不良の薬について、国などから製薬会社に回収を命じること
ができることになりました。[回収命令]
(サリドマイドによる胎児の障害 3つ目の■)
■これをきっかけに、薬の副作用が胎児に及ぶ場合があること
が広く知られ、胎児への影響の確認(動物実験)が義務づけら
れました。また、副作用の発生を監視する制度が作られるなど、
薬の安全性の確認がより注意深くなされるようになりました。
薬の承認審査の際に妊娠動
物による試験の資料を添付
させるようにしました。
薬の副作用が出たとの情報を把握した場合には、製薬企業は国に対して必ず
報告しなければならないことにしました。
[企業による副作用報告]
- 13 -
キノホルム製剤によるスモンの発生やサリドマイドによる胎児の障害の発生を受けて
創設された制度の具体的な内容は以下のとおり。
(キノホルム製剤によるスモンの発生 3つ目の■)
■これらをきっかけに、薬の安全性を確保するための法律改
正や薬の副作用で被害を受けた人を救済する制度の創設がな
されました。スモンは、社会の仕組みに影響を与え、国や製
薬会社、医療従事者といった関係者に様々な教訓をもたらし
た薬害です。
薬の副作用で被害を受け
た人に医療費などを支給
する制度を作りました。
・ 薬は承認審査で承認されて初めて市販されますが、市販後一定期間がたった薬について市
販後の状況を踏まえて再度審査を行うようになりました。
[再審査制度]
・ 医学薬学の進歩に伴い、薬の有効性や安全性に変化があり得ることから既存の薬について
再評価の実施を法律に明記しました。
[再評価制度]
・ ウイルスが混入するなど品質不良の薬について、国などから製薬会社に回収を命じること
ができることになりました。[回収命令]
(サリドマイドによる胎児の障害 3つ目の■)
■これをきっかけに、薬の副作用が胎児に及ぶ場合があること
が広く知られ、胎児への影響の確認(動物実験)が義務づけら
れました。また、副作用の発生を監視する制度が作られるなど、
薬の安全性の確認がより注意深くなされるようになりました。
薬の承認審査の際に妊娠動
物による試験の資料を添付
させるようにしました。
薬の副作用が出たとの情報を把握した場合には、製薬企業は国に対して必ず
報告しなければならないことにしました。
[企業による副作用報告]
- 13 -