よむ、つかう、まなぶ。
薬-1○ 令和5年度薬価改定について (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00050.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第188回 10/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
中医協 薬-1参1
令和3年12月22日
中央社会保険医療協議会 了解
令和4年度薬価制度改革骨子の主な内容
4 . 1 . 1 9
薬価専門部会における薬価算定基準の見直しに関する議論のほか、「経済財政運営と改革の基本方針2021」及び「成長戦略実行計画」 (いずれも
令和3年6月18日閣議決定) を踏まえ、以下のとおり、令和4年度薬価制度改革を行う。
I
革新的な医薬品のイノベーション評価
Ⅲ
1.革新的な効能・効果の追加承認があった新薬の評価
革新的な効能・効果が追加承認された新薬について、一定要件の下、
新薬創出等加算(改定時の引下げ幅を緩和)の対象に追加
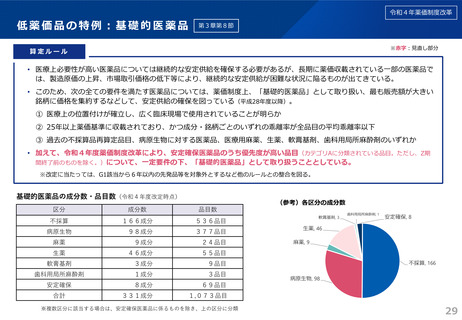
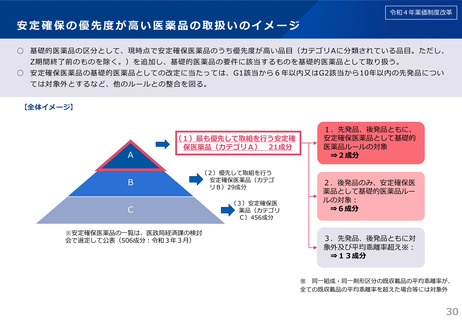
1.安定確保の優先度が高い医薬品の取扱い
長期に薬価収載されている臨床上必要性が高い医薬品の安定確保を図
※次回から適用
る観点から、一定要件の下、「安定確保医薬品」(学会提案に基づき厚労
2.先駆的医薬品及び特定用途医薬品の評価
小児用薬や薬剤耐性菌治療薬等の開発促進の観点から、薬機法に新設さ
れた先駆的医薬品及び特定用途医薬品を新薬創出等加算等の対象に追加
省の専門家会合で策定)のうち優先度が高い品目の薬価を下支え
2.原価計算方式における製造原価の開示度向上
薬価の透明性確保の観点から、製造原価の内訳の開示度が50%未満
3.新型コロナ感染症のワクチン・治療薬の開発の評価
の品目の有用性加算係数を引下げ
新型コロナ感染症ワクチンや治療薬の迅速な開発の評価及び創薬力の強
化継続の観点から、新薬創出等加算の企業指標を見直し、企業区分算出
に当たって、それらの承認取得数1品目ごとに4ptを上乗せ
医薬品の安定供給の確保、
薬価の透明性・予見性の確保
※加えて、今後、移転価格に係る営業利益率のデータ提出をメーカーに協力依頼
3.市場拡大再算定の対象品目の類似品の取扱い
市場拡大再算定の特例で薬価を引き下げられた後、特例の適用日の
Ⅱ
翌日から起算して4年を経過する日までの間は、1回に限り、他品目
国民皆保険の持続性確保の観点からの適正化
1.長期収載品の薬価の適正化
長期収載品の薬価の更なる適正化を図る観点から、長期収載品の特例
引下げ等について、後発品への置換え率別の引下げ率を見直し
(例:置換え率60%未満の品目に対して▲2.0%の引下げ等)
2.新薬創出等加算の適正化
新薬創出等加算の加算係数に係る企業区分間の企業数バランスを考慮
し、 区分Ⅲ(加算が最も低い区分)を拡大(2pt以下までに変更)
の市場拡大再算定の類似品としての引下げ対象から除外
※ 加えて、開発が進みにくい分野での開発促進の観点から「リポジショニング特例」
の取扱いを一部緩和。透明性確保の観点から、薬価算定組織の議事録公開も継続
Ⅳ
その他
○ 調整幅の在り方及び診療報酬改定がない年の薬価改定の在り方につい
ては、引き続き検討
○ 市場規模が年間1,500億円超と見込まれる品目が薬事承認された場
合、通常の薬価算定の手続に先立ち、直ちに中医協に報告し議論
19
令和3年12月22日
中央社会保険医療協議会 了解
令和4年度薬価制度改革骨子の主な内容
4 . 1 . 1 9
薬価専門部会における薬価算定基準の見直しに関する議論のほか、「経済財政運営と改革の基本方針2021」及び「成長戦略実行計画」 (いずれも
令和3年6月18日閣議決定) を踏まえ、以下のとおり、令和4年度薬価制度改革を行う。
I
革新的な医薬品のイノベーション評価
Ⅲ
1.革新的な効能・効果の追加承認があった新薬の評価
革新的な効能・効果が追加承認された新薬について、一定要件の下、
新薬創出等加算(改定時の引下げ幅を緩和)の対象に追加
1.安定確保の優先度が高い医薬品の取扱い
長期に薬価収載されている臨床上必要性が高い医薬品の安定確保を図
※次回から適用
る観点から、一定要件の下、「安定確保医薬品」(学会提案に基づき厚労
2.先駆的医薬品及び特定用途医薬品の評価
小児用薬や薬剤耐性菌治療薬等の開発促進の観点から、薬機法に新設さ
れた先駆的医薬品及び特定用途医薬品を新薬創出等加算等の対象に追加
省の専門家会合で策定)のうち優先度が高い品目の薬価を下支え
2.原価計算方式における製造原価の開示度向上
薬価の透明性確保の観点から、製造原価の内訳の開示度が50%未満
3.新型コロナ感染症のワクチン・治療薬の開発の評価
の品目の有用性加算係数を引下げ
新型コロナ感染症ワクチンや治療薬の迅速な開発の評価及び創薬力の強
化継続の観点から、新薬創出等加算の企業指標を見直し、企業区分算出
に当たって、それらの承認取得数1品目ごとに4ptを上乗せ
医薬品の安定供給の確保、
薬価の透明性・予見性の確保
※加えて、今後、移転価格に係る営業利益率のデータ提出をメーカーに協力依頼
3.市場拡大再算定の対象品目の類似品の取扱い
市場拡大再算定の特例で薬価を引き下げられた後、特例の適用日の
Ⅱ
翌日から起算して4年を経過する日までの間は、1回に限り、他品目
国民皆保険の持続性確保の観点からの適正化
1.長期収載品の薬価の適正化
長期収載品の薬価の更なる適正化を図る観点から、長期収載品の特例
引下げ等について、後発品への置換え率別の引下げ率を見直し
(例:置換え率60%未満の品目に対して▲2.0%の引下げ等)
2.新薬創出等加算の適正化
新薬創出等加算の加算係数に係る企業区分間の企業数バランスを考慮
し、 区分Ⅲ(加算が最も低い区分)を拡大(2pt以下までに変更)
の市場拡大再算定の類似品としての引下げ対象から除外
※ 加えて、開発が進みにくい分野での開発促進の観点から「リポジショニング特例」
の取扱いを一部緩和。透明性確保の観点から、薬価算定組織の議事録公開も継続
Ⅳ
その他
○ 調整幅の在り方及び診療報酬改定がない年の薬価改定の在り方につい
ては、引き続き検討
○ 市場規模が年間1,500億円超と見込まれる品目が薬事承認された場
合、通常の薬価算定の手続に先立ち、直ちに中医協に報告し議論
19