よむ、つかう、まなぶ。
10参考資料1-4 9 価 HPV ワクチンの概要(第17回ワクチン評価に関する小委員会資料2-2) (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000192554_00024.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会 予防接種基本方針部会(第49回 10/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
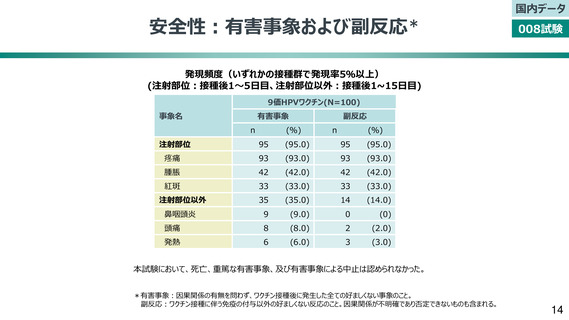
安全性:有害事象および副反応*
国内データ
008試験
発現頻度(いずれかの接種群で発現率5%以上)
(注射部位:接種後1〜5日目、注射部位以外:接種後1~15日目)
9価HPVワクチン(N=100)
事象名
有害事象
n
注射部位
副反応
(%)
n
(%)
95
(95.0)
95
(95.0)
疼痛
93
(93.0)
93
(93.0)
腫脹
42
(42.0)
42
(42.0)
紅斑
33
(33.0)
33
(33.0)
35
(35.0)
14
(14.0)
鼻咽頭炎
9
(9.0)
0
(0)
頭痛
8
(8.0)
2
(2.0)
発熱
6
(6.0)
3
(3.0)
注射部位以外
本試験において、死亡、重篤な有害事象、及び有害事象による中止は認められなかった。
*有害事象:因果関係の有無を問わず、ワクチン接種後に発生した全ての好ましくない事象のこと。
副反応:ワクチン接種に伴う免疫の付与以外の好ましくない反応のこと。因果関係が不明確であり否定できないものも含まれる。
14
国内データ
008試験
発現頻度(いずれかの接種群で発現率5%以上)
(注射部位:接種後1〜5日目、注射部位以外:接種後1~15日目)
9価HPVワクチン(N=100)
事象名
有害事象
n
注射部位
副反応
(%)
n
(%)
95
(95.0)
95
(95.0)
疼痛
93
(93.0)
93
(93.0)
腫脹
42
(42.0)
42
(42.0)
紅斑
33
(33.0)
33
(33.0)
35
(35.0)
14
(14.0)
鼻咽頭炎
9
(9.0)
0
(0)
頭痛
8
(8.0)
2
(2.0)
発熱
6
(6.0)
3
(3.0)
注射部位以外
本試験において、死亡、重篤な有害事象、及び有害事象による中止は認められなかった。
*有害事象:因果関係の有無を問わず、ワクチン接種後に発生した全ての好ましくない事象のこと。
副反応:ワクチン接種に伴う免疫の付与以外の好ましくない反応のこと。因果関係が不明確であり否定できないものも含まれる。
14