よむ、つかう、まなぶ。
10参考資料1-4 9 価 HPV ワクチンの概要(第17回ワクチン評価に関する小委員会資料2-2) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000192554_00024.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会 予防接種基本方針部会(第49回 10/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
9価ワクチン(V503)臨床試験一覧
V503-001:後期第Ⅱ相/第Ⅲ相国際共同試験(日本も参加)
16~26歳女性を対象とした二重盲検比較試験
パートA(後期第Ⅱ相):3用量より用量を選択(N=1,242)
パートB(第Ⅲ相)
:中用量のV503を用いて有効性、免疫原性及び安全性を4価ワクチンと比較
(N=14,215、日本人254例を含む)
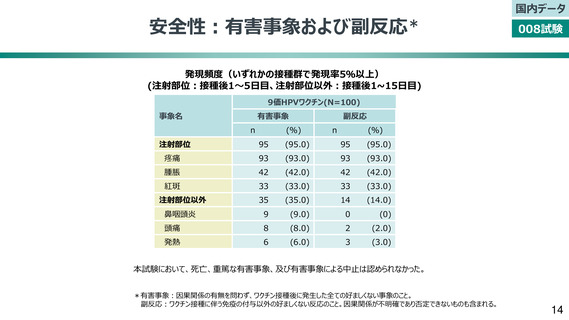
V503-008:第Ⅲ相国内臨床試験
9~15歳の女性(N=100)を対象として免疫原性及び安全性を評価する非盲検試験
5つの第Ⅲ相海外臨床試験(安全性及び免疫原性を評価)
V503-002:
9 ~15歳男女(N=2,604)及び16~26歳女性(N=470)を対象とした免疫原性、安全性、ロット間一致性試験
V503-005:
11~15歳男女(N=1,241)を対象としたMenactra™及びAdacel™と同時接種時の免疫原性及び安全性試験
V503-006:ガーダシル既接種の12~26歳女性(N= 924)を対象としたV503の安全性及び免疫原性試験
V503-007:11~15歳男女(N=1.054)を対象としたRepevax™と同時接種時の免疫原性及び安全性試験
V503-009:9 ~15歳女性(N= 600)を対象とした免疫原性及び安全性試験
5
V503-001:後期第Ⅱ相/第Ⅲ相国際共同試験(日本も参加)
16~26歳女性を対象とした二重盲検比較試験
パートA(後期第Ⅱ相):3用量より用量を選択(N=1,242)
パートB(第Ⅲ相)
:中用量のV503を用いて有効性、免疫原性及び安全性を4価ワクチンと比較
(N=14,215、日本人254例を含む)
V503-008:第Ⅲ相国内臨床試験
9~15歳の女性(N=100)を対象として免疫原性及び安全性を評価する非盲検試験
5つの第Ⅲ相海外臨床試験(安全性及び免疫原性を評価)
V503-002:
9 ~15歳男女(N=2,604)及び16~26歳女性(N=470)を対象とした免疫原性、安全性、ロット間一致性試験
V503-005:
11~15歳男女(N=1,241)を対象としたMenactra™及びAdacel™と同時接種時の免疫原性及び安全性試験
V503-006:ガーダシル既接種の12~26歳女性(N= 924)を対象としたV503の安全性及び免疫原性試験
V503-007:11~15歳男女(N=1.054)を対象としたRepevax™と同時接種時の免疫原性及び安全性試験
V503-009:9 ~15歳女性(N= 600)を対象とした免疫原性及び安全性試験
5