よむ、つかう、まなぶ。
資料1-8 副反応疑い報告の状況について (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html |
| 出典情報 | 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第14回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(10/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
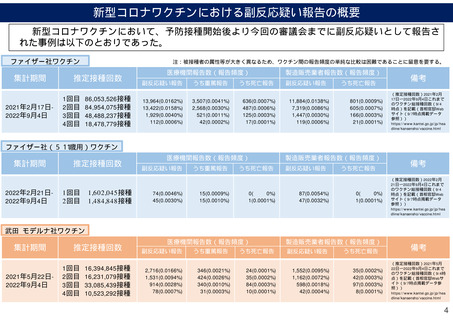
米国ワクチン安全データリンク(VSD)に基づく新型コロナワクチン
(mRNAワクチン)接種後の有害事象の中間解析の結果について①
(2021年9月10日審議会資料一部改編)
○ 米国ワクチン安全データリンク(VSD)を用いた新型コロナワクチン(mRNAワクチン)接種後の重篤な疾患の発症
リスクの中間解析の結果では、全ての対象疾患※について接種後1-21日のリスク期間の発症率の有意な上昇を認めな
かった。
○ 心筋炎/心外膜炎に関しては、12-39歳において特に2回目接種後の発症率の上昇を認めた。
【研究方法の概要】
•
Nicola Klein et al. Surveillance for Adverse Events After COVID-19 mRNA Vaccination
JAMA 2021, doi: 10.1001/jama.2021.15072.
米国において、予防接種歴と医療記録を含むデータベースである Vaccine Safety Datalink(VSD)* を用い、新型コロナワク
チン接種後における、重篤な疾患の発症リスクについて中間解析が行われた。
•
解析対象期間は2020年12月14日から2021年6月26日とし、 VSDにデータを提供する8つの健康保険への12歳以上の加入
者を対象とした。また、mRNAワクチン(Pfizer-BioNTech社のBNT162b2またはModerna社のmRNA-1273)を解析対象の
ワクチンとした。
•
ワクチン接種後1-21日をリスク期間、22-42日を比較期間とし、対象疾患について、年齢、性別、人種等で調整の上、ポアソ
ン回帰を用いてaRR (adjusted rate ratio, 調整率比)を算出した。
※対象疾患
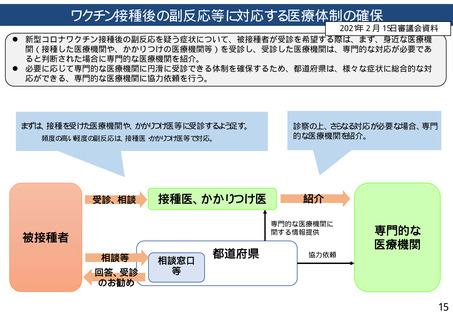
血栓性血小板減少性紫斑病、脳静脈洞血栓症、横断性脊髄炎、脳炎/脊髄炎/脳脊髄炎、
21日間(比較期間)
心筋炎/心外膜炎、静脈血栓症、免疫性血小板減少症、けいれん、急性心筋梗塞、
肺血栓症、ベル麻痺、虚血性脳卒中、出血性脳卒中、血小板減少を伴う血栓症、虫垂炎、
ギラン・バレ症候群、播種性血管内凝固症候群、川崎病、急性散在性脳脊髄炎
21日間(リスク期間)
eFigure1(supplement)より改変
*VSD( Vaccine Safety Datalink )については下記を参照
( 紙谷参考人提出資料)米国の予防接種安全性監視システムについて https://www.mhlw.go.jp/content/10601000/000776374.pdf
第57回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和3年度第4回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)
26
(mRNAワクチン)接種後の有害事象の中間解析の結果について①
(2021年9月10日審議会資料一部改編)
○ 米国ワクチン安全データリンク(VSD)を用いた新型コロナワクチン(mRNAワクチン)接種後の重篤な疾患の発症
リスクの中間解析の結果では、全ての対象疾患※について接種後1-21日のリスク期間の発症率の有意な上昇を認めな
かった。
○ 心筋炎/心外膜炎に関しては、12-39歳において特に2回目接種後の発症率の上昇を認めた。
【研究方法の概要】
•
Nicola Klein et al. Surveillance for Adverse Events After COVID-19 mRNA Vaccination
JAMA 2021, doi: 10.1001/jama.2021.15072.
米国において、予防接種歴と医療記録を含むデータベースである Vaccine Safety Datalink(VSD)* を用い、新型コロナワク
チン接種後における、重篤な疾患の発症リスクについて中間解析が行われた。
•
解析対象期間は2020年12月14日から2021年6月26日とし、 VSDにデータを提供する8つの健康保険への12歳以上の加入
者を対象とした。また、mRNAワクチン(Pfizer-BioNTech社のBNT162b2またはModerna社のmRNA-1273)を解析対象の
ワクチンとした。
•
ワクチン接種後1-21日をリスク期間、22-42日を比較期間とし、対象疾患について、年齢、性別、人種等で調整の上、ポアソ
ン回帰を用いてaRR (adjusted rate ratio, 調整率比)を算出した。
※対象疾患
血栓性血小板減少性紫斑病、脳静脈洞血栓症、横断性脊髄炎、脳炎/脊髄炎/脳脊髄炎、
21日間(比較期間)
心筋炎/心外膜炎、静脈血栓症、免疫性血小板減少症、けいれん、急性心筋梗塞、
肺血栓症、ベル麻痺、虚血性脳卒中、出血性脳卒中、血小板減少を伴う血栓症、虫垂炎、
ギラン・バレ症候群、播種性血管内凝固症候群、川崎病、急性散在性脳脊髄炎
21日間(リスク期間)
eFigure1(supplement)より改変
*VSD( Vaccine Safety Datalink )については下記を参照
( 紙谷参考人提出資料)米国の予防接種安全性監視システムについて https://www.mhlw.go.jp/content/10601000/000776374.pdf
第57回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和3年度第4回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)
26