よむ、つかう、まなぶ。
資料7 先進医療Bの試験実施計画の変更について(告示番号47/ jRCTs031200326) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28927.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第141回 11/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療Bの試験実施計画の変更について
【申請医療機関】
国立研究開発法人国立がん研究センター中央病院
【先進医療告示番号と名称】
大臣告示番号 B47
メトホルミン経口投与及びテモゾロミド経口投与の併用療法
【適応症】
膠芽腫(初発のものであって、テモゾロミド経口投与及び放射線治療の併用療法
後のものに限る。)
【試験の概要】
初発膠芽腫患者に対するテモゾロミド併用放射線初期治療後のメトホルミン併
用テモゾロミド維持療法の安全性を評価し、本療法におけるメトホルミンの推
奨用量(Recommended dose:RD)を決定する(Phase I)。さらに、決定した
推奨用量において症例数を追加し、安全性および有効性を評価する(Phase
II)。
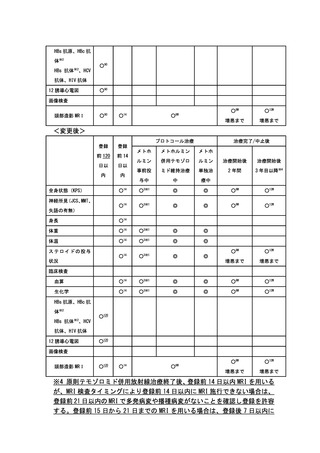
主要評価項目:
Phase I 部分:用量制限毒性(Dose limiting toxicity: DLT)発現割合
Phase II 部分:12 ヵ月無増悪生存割合
副次評価項目:有害事象発現割合、6 ヵ月無増悪生存割合、12 ヵ月無増悪生存
割合、12 ヵ月生存割合、全生存期間、奏効割合、有害事象発生割合、プロトコ
ール治療完遂割合
【医薬品・医療機器情報】
メトグ
大日本住友製
1 錠中メトホルミ
医薬品医
療機器法
承認
又は
認証番号
22200AM
ルコ錠
薬株式会社
ン塩酸塩 250mg
X00234
テモゾ
日本化薬株式
1 錠中テモゾロミ
22900AM
・悪性神経膠腫
ロミド
会社
ド 20.0mg を含有
X00866
・再発又は難治
品目名
製造販売業者
名
規
格
医薬品医療機器
法承認又は
認証上の適応
医薬品医療
機器法上の
適応外使用
の該当
2 型糖尿病
適応外
適応内
250mg
錠 20mg
「NK」
する
性のユーイング
肉腫
【申請医療機関】
国立研究開発法人国立がん研究センター中央病院
【先進医療告示番号と名称】
大臣告示番号 B47
メトホルミン経口投与及びテモゾロミド経口投与の併用療法
【適応症】
膠芽腫(初発のものであって、テモゾロミド経口投与及び放射線治療の併用療法
後のものに限る。)
【試験の概要】
初発膠芽腫患者に対するテモゾロミド併用放射線初期治療後のメトホルミン併
用テモゾロミド維持療法の安全性を評価し、本療法におけるメトホルミンの推
奨用量(Recommended dose:RD)を決定する(Phase I)。さらに、決定した
推奨用量において症例数を追加し、安全性および有効性を評価する(Phase
II)。
主要評価項目:
Phase I 部分:用量制限毒性(Dose limiting toxicity: DLT)発現割合
Phase II 部分:12 ヵ月無増悪生存割合
副次評価項目:有害事象発現割合、6 ヵ月無増悪生存割合、12 ヵ月無増悪生存
割合、12 ヵ月生存割合、全生存期間、奏効割合、有害事象発生割合、プロトコ
ール治療完遂割合
【医薬品・医療機器情報】
メトグ
大日本住友製
1 錠中メトホルミ
医薬品医
療機器法
承認
又は
認証番号
22200AM
ルコ錠
薬株式会社
ン塩酸塩 250mg
X00234
テモゾ
日本化薬株式
1 錠中テモゾロミ
22900AM
・悪性神経膠腫
ロミド
会社
ド 20.0mg を含有
X00866
・再発又は難治
品目名
製造販売業者
名
規
格
医薬品医療機器
法承認又は
認証上の適応
医薬品医療
機器法上の
適応外使用
の該当
2 型糖尿病
適応外
適応内
250mg
錠 20mg
「NK」
する
性のユーイング
肉腫