よむ、つかう、まなぶ。
資料4-6 医薬品等の緊急承認に係る添付文書等の記載要領の改正について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
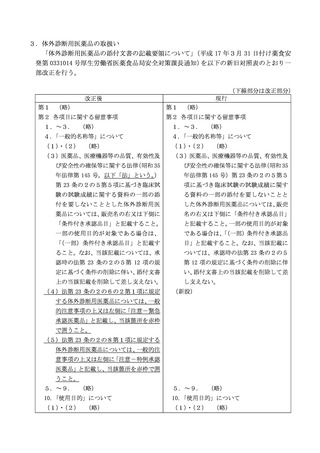
3.「体外診断用医薬品の電子化された添付文書の記載要領について」(令和3
年6月 11 日付け薬生発第 0611 第5号厚生労働省医薬・生活衛生局長通知)の
別添を以下の新旧対照表のとおり一部改正を行う。
(下線部分は改正部分)
現行
改正後
1.
(略)
1.
(略)
2.記載要領
2.記載要領
(1)~(4) (略)
(1)~(4) (略)
(5)一般的名称等
(5)一般的名称等
体外診断用医薬品の一般的名称を
体外診断用医薬品の一般的名称を
記載すること。シリーズ品は、シリ
記載すること。シリーズ品は、シリー
ーズの一般的名称及び各構成製品の
ズの一般的名称及び各構成製品の一
一般的名称を併せて記載すること。
般的名称を併せて記載すること。ま
また、条件付き承認、緊急承認又は
た、条件付き承認された体外診断用
特例承認された体外診断用医薬品の
医薬品の場合にはその旨を記載する
場合にはその旨を記載すること。
こと。
(6)~(23) (略)
(6)~(23) (略)
4.
「再生医療等製品の電子化された添付文書の記載要領について」
(令和3年6
月 11 日付け薬生発 0611 第 13 号厚生労働省医薬・生活衛生局長通知)の別添
を以下の新旧対照表のとおり一部改正を行う。
(下線部分は改正部分)
現行
改正後
1.・2. (略)
1.・2. (略)
3.記載要領
3.記載要領
(1)
・
(2) (略)
(1)・(2) (略)
(3)類別及び一般的名称等
(3)類別及び一般的名称等
承認時に付与された再生医療等製
承認時に付与された再生医療等製
品の類別、一般的名称及び条件及び
品の類別、一般的名称及び条件及び期
期限付承認、緊急承認又は特例承認
限付承認された場合にはその旨を記
された場合にはその旨を記載するこ
載すること。
と。
なお、一つの承認に係る再生医療等
なお、一つの承認に係る再生医療
製品がコンビネーション製品であっ
等製品がコンビネーション製品であ
て、該当する一般的名称が複数になる
年6月 11 日付け薬生発第 0611 第5号厚生労働省医薬・生活衛生局長通知)の
別添を以下の新旧対照表のとおり一部改正を行う。
(下線部分は改正部分)
現行
改正後
1.
(略)
1.
(略)
2.記載要領
2.記載要領
(1)~(4) (略)
(1)~(4) (略)
(5)一般的名称等
(5)一般的名称等
体外診断用医薬品の一般的名称を
体外診断用医薬品の一般的名称を
記載すること。シリーズ品は、シリ
記載すること。シリーズ品は、シリー
ーズの一般的名称及び各構成製品の
ズの一般的名称及び各構成製品の一
一般的名称を併せて記載すること。
般的名称を併せて記載すること。ま
また、条件付き承認、緊急承認又は
た、条件付き承認された体外診断用
特例承認された体外診断用医薬品の
医薬品の場合にはその旨を記載する
場合にはその旨を記載すること。
こと。
(6)~(23) (略)
(6)~(23) (略)
4.
「再生医療等製品の電子化された添付文書の記載要領について」
(令和3年6
月 11 日付け薬生発 0611 第 13 号厚生労働省医薬・生活衛生局長通知)の別添
を以下の新旧対照表のとおり一部改正を行う。
(下線部分は改正部分)
現行
改正後
1.・2. (略)
1.・2. (略)
3.記載要領
3.記載要領
(1)
・
(2) (略)
(1)・(2) (略)
(3)類別及び一般的名称等
(3)類別及び一般的名称等
承認時に付与された再生医療等製
承認時に付与された再生医療等製
品の類別、一般的名称及び条件及び
品の類別、一般的名称及び条件及び期
期限付承認、緊急承認又は特例承認
限付承認された場合にはその旨を記
された場合にはその旨を記載するこ
載すること。
と。
なお、一つの承認に係る再生医療等
なお、一つの承認に係る再生医療
製品がコンビネーション製品であっ
等製品がコンビネーション製品であ
て、該当する一般的名称が複数になる