よむ、つかう、まなぶ。
資料4-6 医薬品等の緊急承認に係る添付文書等の記載要領の改正について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
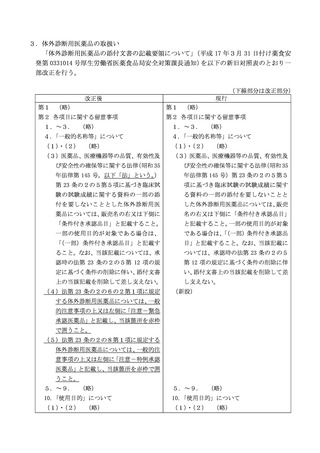
3.体外診断用医薬品の取扱い
「体外診断用医薬品の添付文書の記載要領について」(平成 17 年3月 31 日付け薬食安
発第 0331014 号厚生労働省医薬食品局安全対策課長通知)を以下の新旧対照表のとおり一
部改正を行う。
(下線部分は改正部分)
改正後
現行
第1 (略)
第1 (略)
第2 各項目に関する留意事項
第2 各項目に関する留意事項
1.~3. (略)
1.~3. (略)
4.「一般的名称等」について
4.「一般的名称等」について
(1)・(2) (略)
(1)・(2) (略)
(3)医薬品、医療機器等の品質、有効性及
(3)医薬品、医療機器等の品質、有効性及
び安全性の確保等に関する法律
(昭和 35
び安全性の確保等に関する法律(昭和 35
年法律第 145 号。以下「法」という。)
年法律第 145 号)第 23 条の2の5第5
第 23 条の2の5第5項に基づき臨床試
項に基づき臨床試験の試験成績に関す
験の試験成績に関する資料の一部の添
る資料の一部の添付を要しないことと
付を要しないこととした体外診断用医
した体外診断用医薬品については、販売
薬品については、販売名の右又は下側に
名の右又は下側に「条件付き承認品目」
「条件付き承認品目」と記載すること。
と記載すること。一部の使用目的が対象
一部の使用目的が対象である場合は、
である場合は、
「(一部)条件付き承認品
「(一部)条件付き承認品目」と記載す
目」と記載すること。なお、当該記載に
ること。なお、当該記載については、承
ついては、承認時の法第 23 条の2の5
認時の法第 23 条の2の5第 12 項の規
第 12 項の規定に基づく条件の削除に伴
定に基づく条件の削除に伴い、添付文書
い、添付文書上の当該記載を削除して差
上の当該記載を削除して差し支えない。
し支えない。
(4)法第 23 条の2の6の2第1項に規定
(新設)
する体外診断用医薬品については、一般
的注意事項の上又は左側に「注意-緊急
承認医薬品」と記載し、当該箇所を赤枠
で囲うこと。
(5)法第 23 条の2の8第1項に規定する
体外診断用医薬品については、一般的注
意事項の上又は左側に「注意-特例承認
医薬品」と記載し、当該箇所を赤枠で囲
うこと。
5.~9. (略)
5.~9.
(略)
10.「使用目的」について
10.「使用目的」について
(1)・(2) (略)
(1)・(2) (略)
「体外診断用医薬品の添付文書の記載要領について」(平成 17 年3月 31 日付け薬食安
発第 0331014 号厚生労働省医薬食品局安全対策課長通知)を以下の新旧対照表のとおり一
部改正を行う。
(下線部分は改正部分)
改正後
現行
第1 (略)
第1 (略)
第2 各項目に関する留意事項
第2 各項目に関する留意事項
1.~3. (略)
1.~3. (略)
4.「一般的名称等」について
4.「一般的名称等」について
(1)・(2) (略)
(1)・(2) (略)
(3)医薬品、医療機器等の品質、有効性及
(3)医薬品、医療機器等の品質、有効性及
び安全性の確保等に関する法律
(昭和 35
び安全性の確保等に関する法律(昭和 35
年法律第 145 号。以下「法」という。)
年法律第 145 号)第 23 条の2の5第5
第 23 条の2の5第5項に基づき臨床試
項に基づき臨床試験の試験成績に関す
験の試験成績に関する資料の一部の添
る資料の一部の添付を要しないことと
付を要しないこととした体外診断用医
した体外診断用医薬品については、販売
薬品については、販売名の右又は下側に
名の右又は下側に「条件付き承認品目」
「条件付き承認品目」と記載すること。
と記載すること。一部の使用目的が対象
一部の使用目的が対象である場合は、
である場合は、
「(一部)条件付き承認品
「(一部)条件付き承認品目」と記載す
目」と記載すること。なお、当該記載に
ること。なお、当該記載については、承
ついては、承認時の法第 23 条の2の5
認時の法第 23 条の2の5第 12 項の規
第 12 項の規定に基づく条件の削除に伴
定に基づく条件の削除に伴い、添付文書
い、添付文書上の当該記載を削除して差
上の当該記載を削除して差し支えない。
し支えない。
(4)法第 23 条の2の6の2第1項に規定
(新設)
する体外診断用医薬品については、一般
的注意事項の上又は左側に「注意-緊急
承認医薬品」と記載し、当該箇所を赤枠
で囲うこと。
(5)法第 23 条の2の8第1項に規定する
体外診断用医薬品については、一般的注
意事項の上又は左側に「注意-特例承認
医薬品」と記載し、当該箇所を赤枠で囲
うこと。
5.~9. (略)
5.~9.
(略)
10.「使用目的」について
10.「使用目的」について
(1)・(2) (略)
(1)・(2) (略)