よむ、つかう、まなぶ。
参考資料4:「人を対象とする生命科学・医学系研究に関する倫理指針の一部を改正する件(概要)」パブリック・コメント意見一覧 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30490.html |
| 出典情報 | 生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(第8回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
31
改正(概要)II.内容(案)
3インフォームド・コンセント
(以下「IC」という。)を
受ける手続等の見直し
32
改正(概要)II.内容(案)
ー
3インフォームド・コンセント
(以下「IC」という。)を
受ける手続等の見直しにつ
いて
改正(概要)II.内容(案)
ー
3インフォームド・コンセント
(以下「IC」という。)を
受ける手続等の見直し
33
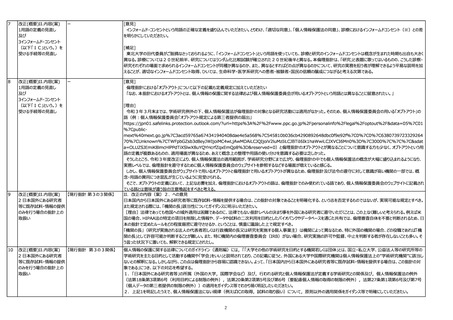
【現行指針 第8の7関係】
将来への様々な研究への利用を目的としたデータベースや疾患レジストリ?研究、バイオバンク等(以下バイオバンク等)においては、他の研究機関への提供が前提であるものの、同意
取得時点では将来の具体的研究は決まっておらず、バイオバンク等が、利用者範囲、管理責任の情報を説明したうえでの適切な同意を得ることができない。また、バイオバンク等から試
料・情報を提供して研究が行われる場合、対象となる研究対象者の連絡先が変更されていたり、対象となる人数が多い場合など、具体的研究目的や提供先が決まった時点で再同意
を取得することは困難なことがある。
そこで、生命・医学系指針におけるIC規定について、将来の研究への利用・提供について包括的な同意が取得されている場合には、通知または公開で既存試料・情報を利用・提供可
能となるよう以下を希望する。
1.他の研究機関に既存試料・情報を提供しようとする場合において、「自らの研究機関において保有している既存試料・情報を研究に用いる場合」と同様に、既に同意を得ている研
究の目的と相当の関連性があると合理的に認められ、他の研究機関への提供が説明されている場合には通知又は公開で提供可能な旨を規定。
2.「同意を受ける時点で特定されなかった研究への試料・情報の利用の手続」について、「研究者等」の手続きだけでなく「他の研究機関に対して既存試料・情報の提供を行う者」の
手続きについても記載。
・自らの研究機関のみであっても、多施設共同研究においても、各研究機関が保有している既存試料・情報を用いて、観察研究を実施する場合、既存の試料・情報を用いる研究であ
る場合のため、オプトアウトに一本化されるという解釈で問題ないか。
今次改正により、ICを行わずに匿名加工情報を研究に用いるための要件や、既存試料・情報を別目的で利用するための要件が緩和されたことを歓迎。医療のリアルワールドデータの活
用促進に向けて、是非取り進めていくべき。
34
改正(概要)II.内容(案)
4オプトアウト手続のあり方
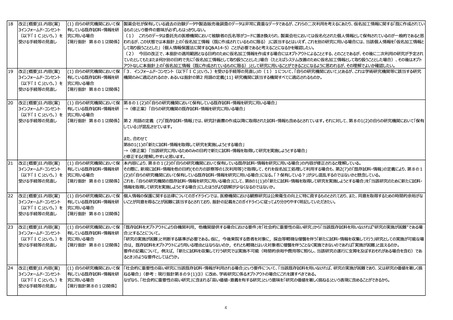
(1) 研究機関の長等の責務【現 研究機関の長等の責務としての「オプトアウトの適切な実施」の内容として,オプトアウトを受け付ける期間をある程度確保するよう,求めてはどうか。
行指針第5の2、第8の1⑷ 既存情報のみを用いる研究の場合,オプトアウトにより実施される例がほとんどだと思われるが,必ずしも十分な期間オプトアウトを受け付けていないのではないかと思われる例(代表機
関係】
関から既存試料・情報の提供依頼を受けた時点で,既にオプトアウト文書での拒否の申し出期限が数日後に迫っている等)が散見される。当施設ではオプトアウト受付期間の延長を
代表に申し入れたが,機関によってはそのまま提供(実際オプトアウトを申し出る機会が無いにも係わらず)許可してしまっているところもあるのではないかと思われる。
35
改正(概要)II.内容(案)
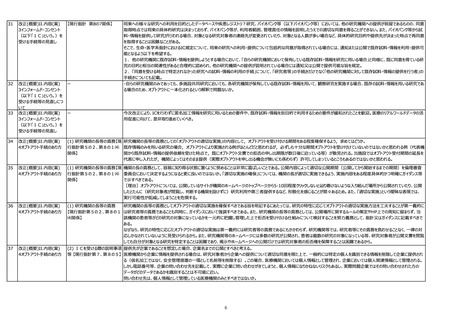
4オプトアウト手続のあり方
(1) 研究機関の長等の責務【現 機関の長の責務として、容易に知り得る状態に置くように努めることは非常に喜ばしいことである。公開内容によって適切な公開期間(公開してから開始するまでの期間)を倫理審査
行指針第5の2、第8の1⑷ 委員会において決定するようになると更に良いのではないか。「適切な実施の確保」については、機関の長が適切に実施できるよう、実施内容をある程度具体的かつ明確にガイダンス等
関係】
で示すべきである。
[理由]オプトアウトについては、公開しているサイトが機関のホームページのトップページから5-10回程度クリックしないと辿り着けないような入り組んだ場所から公開されていたり、公開
したとたんに(研究対象者が閲覧し、判断する機関を設けずに)研究利用や第三者提供するなど、形骸化を感じることが間々あるため。また、「適切な実施」という曖昧な表現では、
実行可能性が低減してしまうことを危惧する。
36
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(1) 研究機関の長等の責務
研究機関の長等の責務としてオプトアウトの適切な実施を確保すべきである旨を明記するにあたっては、研究の特性に応じてオプトアウトの適切な実施方法を工夫することが第一義的に
【現行指針第5の2、第8の1 は研究者等の責務であることも同時に、ガイダンスにおいて強調すべきである。また、研究機関の長等の責務としては、公開場所に関するルールの策定やHP上での周知に留まらず、当
⑷関係】
該機関の患者等がどの研究の対象になっているかを一元的に把握し管理した上で拒否を受け付ける仕組みについて検討することを努力義務として、指針又はガイダンスに記載すべきで
ある。
なぜなら、研究の特性に応じたオプトアウトの適切な実施は第一義的には研究者等の責務であるにもかかわらず、研究機関等では、研究者等にその責務を負わせることなく、一律の対
応しかなされていないように見受けられるから。また、研究機関等のホームページには多数の研究が公開され、患者は複数の研究の対象になっている等、研究対象者が公開文書を閲覧
しても自分が対象となる研究を特定することは困難であり、掲示やホームページへの公開だけでは研究対象者の拒否権を保障することは困難であるから。
37
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(2) ICを受ける際の説明事項 提供先が企業であることを想定した場合、企業名までの公開とすべきと考える。
等 【現行指針第7、第8の5】 医療機関から企業に情報を提供される場合は、研究対象者から企業への提供について適切な同意を得た上で、一般的には特定の個人を識別できる情報を削除して企業に提供され
る(仮名加工ではなく、安全管理措置の一環として名前等を削除する)。この場合、医療機関においては個人情報として管理され、企業においては個人関連情報として管理される。
しかし電話番号等、企業の問い合わせ先を記載して、実際に企業に問い合わせがきてしまうと、個人情報になりかねないリスクもあるし、実際問題企業ではその問い合わせされた方の
データがどのデータであるかを識別することは不可能に近い。
問い合わせ先は、個人情報として管理している医療機関のみとすべきではないか。
6
改正(概要)II.内容(案)
3インフォームド・コンセント
(以下「IC」という。)を
受ける手続等の見直し
32
改正(概要)II.内容(案)
ー
3インフォームド・コンセント
(以下「IC」という。)を
受ける手続等の見直しにつ
いて
改正(概要)II.内容(案)
ー
3インフォームド・コンセント
(以下「IC」という。)を
受ける手続等の見直し
33
【現行指針 第8の7関係】
将来への様々な研究への利用を目的としたデータベースや疾患レジストリ?研究、バイオバンク等(以下バイオバンク等)においては、他の研究機関への提供が前提であるものの、同意
取得時点では将来の具体的研究は決まっておらず、バイオバンク等が、利用者範囲、管理責任の情報を説明したうえでの適切な同意を得ることができない。また、バイオバンク等から試
料・情報を提供して研究が行われる場合、対象となる研究対象者の連絡先が変更されていたり、対象となる人数が多い場合など、具体的研究目的や提供先が決まった時点で再同意
を取得することは困難なことがある。
そこで、生命・医学系指針におけるIC規定について、将来の研究への利用・提供について包括的な同意が取得されている場合には、通知または公開で既存試料・情報を利用・提供可
能となるよう以下を希望する。
1.他の研究機関に既存試料・情報を提供しようとする場合において、「自らの研究機関において保有している既存試料・情報を研究に用いる場合」と同様に、既に同意を得ている研
究の目的と相当の関連性があると合理的に認められ、他の研究機関への提供が説明されている場合には通知又は公開で提供可能な旨を規定。
2.「同意を受ける時点で特定されなかった研究への試料・情報の利用の手続」について、「研究者等」の手続きだけでなく「他の研究機関に対して既存試料・情報の提供を行う者」の
手続きについても記載。
・自らの研究機関のみであっても、多施設共同研究においても、各研究機関が保有している既存試料・情報を用いて、観察研究を実施する場合、既存の試料・情報を用いる研究であ
る場合のため、オプトアウトに一本化されるという解釈で問題ないか。
今次改正により、ICを行わずに匿名加工情報を研究に用いるための要件や、既存試料・情報を別目的で利用するための要件が緩和されたことを歓迎。医療のリアルワールドデータの活
用促進に向けて、是非取り進めていくべき。
34
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(1) 研究機関の長等の責務【現 研究機関の長等の責務としての「オプトアウトの適切な実施」の内容として,オプトアウトを受け付ける期間をある程度確保するよう,求めてはどうか。
行指針第5の2、第8の1⑷ 既存情報のみを用いる研究の場合,オプトアウトにより実施される例がほとんどだと思われるが,必ずしも十分な期間オプトアウトを受け付けていないのではないかと思われる例(代表機
関係】
関から既存試料・情報の提供依頼を受けた時点で,既にオプトアウト文書での拒否の申し出期限が数日後に迫っている等)が散見される。当施設ではオプトアウト受付期間の延長を
代表に申し入れたが,機関によってはそのまま提供(実際オプトアウトを申し出る機会が無いにも係わらず)許可してしまっているところもあるのではないかと思われる。
35
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(1) 研究機関の長等の責務【現 機関の長の責務として、容易に知り得る状態に置くように努めることは非常に喜ばしいことである。公開内容によって適切な公開期間(公開してから開始するまでの期間)を倫理審査
行指針第5の2、第8の1⑷ 委員会において決定するようになると更に良いのではないか。「適切な実施の確保」については、機関の長が適切に実施できるよう、実施内容をある程度具体的かつ明確にガイダンス等
関係】
で示すべきである。
[理由]オプトアウトについては、公開しているサイトが機関のホームページのトップページから5-10回程度クリックしないと辿り着けないような入り組んだ場所から公開されていたり、公開
したとたんに(研究対象者が閲覧し、判断する機関を設けずに)研究利用や第三者提供するなど、形骸化を感じることが間々あるため。また、「適切な実施」という曖昧な表現では、
実行可能性が低減してしまうことを危惧する。
36
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(1) 研究機関の長等の責務
研究機関の長等の責務としてオプトアウトの適切な実施を確保すべきである旨を明記するにあたっては、研究の特性に応じてオプトアウトの適切な実施方法を工夫することが第一義的に
【現行指針第5の2、第8の1 は研究者等の責務であることも同時に、ガイダンスにおいて強調すべきである。また、研究機関の長等の責務としては、公開場所に関するルールの策定やHP上での周知に留まらず、当
⑷関係】
該機関の患者等がどの研究の対象になっているかを一元的に把握し管理した上で拒否を受け付ける仕組みについて検討することを努力義務として、指針又はガイダンスに記載すべきで
ある。
なぜなら、研究の特性に応じたオプトアウトの適切な実施は第一義的には研究者等の責務であるにもかかわらず、研究機関等では、研究者等にその責務を負わせることなく、一律の対
応しかなされていないように見受けられるから。また、研究機関等のホームページには多数の研究が公開され、患者は複数の研究の対象になっている等、研究対象者が公開文書を閲覧
しても自分が対象となる研究を特定することは困難であり、掲示やホームページへの公開だけでは研究対象者の拒否権を保障することは困難であるから。
37
改正(概要)II.内容(案)
4オプトアウト手続のあり方
(2) ICを受ける際の説明事項 提供先が企業であることを想定した場合、企業名までの公開とすべきと考える。
等 【現行指針第7、第8の5】 医療機関から企業に情報を提供される場合は、研究対象者から企業への提供について適切な同意を得た上で、一般的には特定の個人を識別できる情報を削除して企業に提供され
る(仮名加工ではなく、安全管理措置の一環として名前等を削除する)。この場合、医療機関においては個人情報として管理され、企業においては個人関連情報として管理される。
しかし電話番号等、企業の問い合わせ先を記載して、実際に企業に問い合わせがきてしまうと、個人情報になりかねないリスクもあるし、実際問題企業ではその問い合わせされた方の
データがどのデータであるかを識別することは不可能に近い。
問い合わせ先は、個人情報として管理している医療機関のみとすべきではないか。
6