資料3-2 製造販売業者からの国内副作用等報告の状況 (463 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
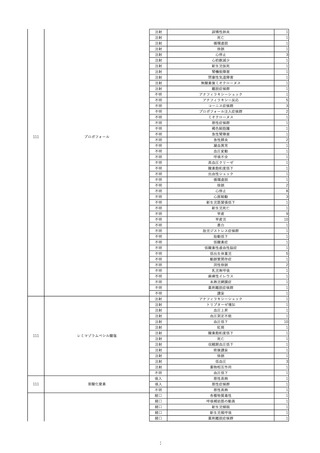
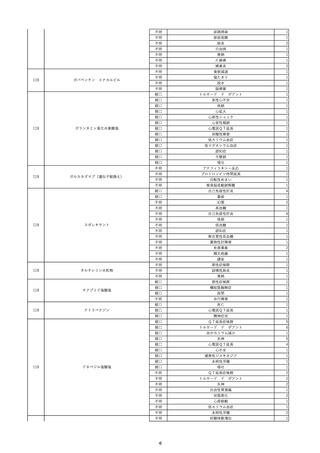
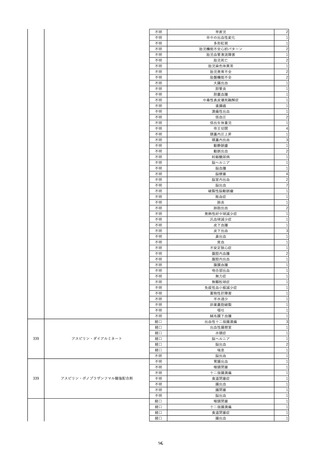
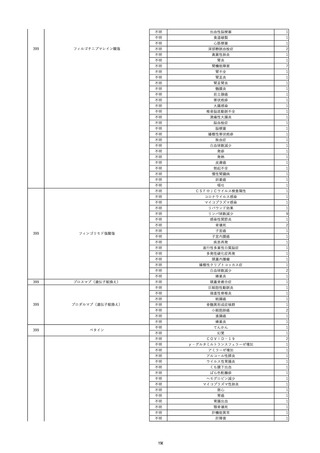
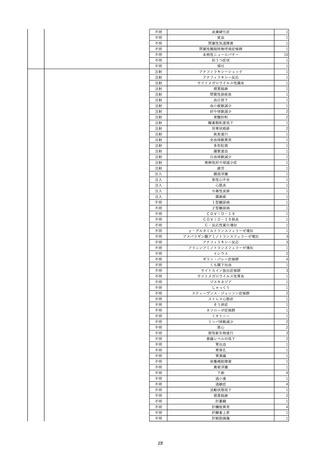
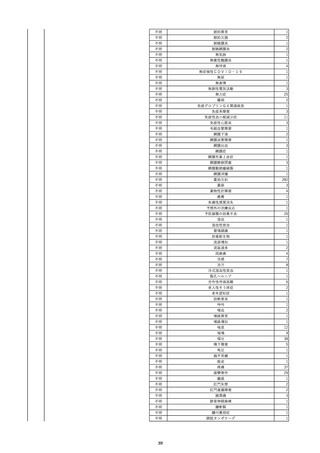
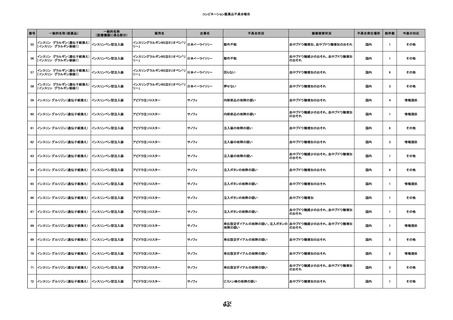
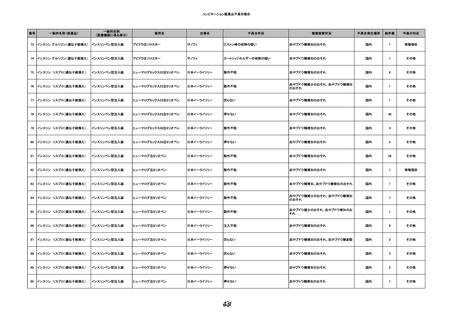
15
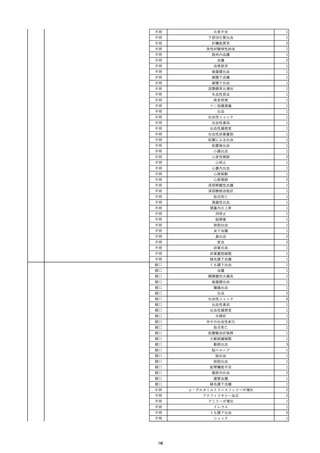
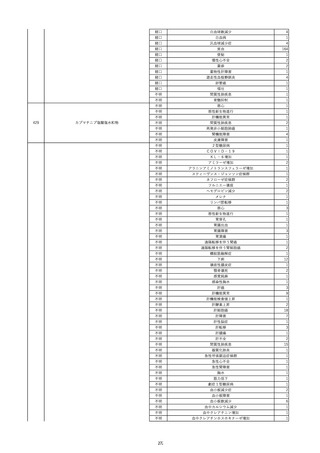
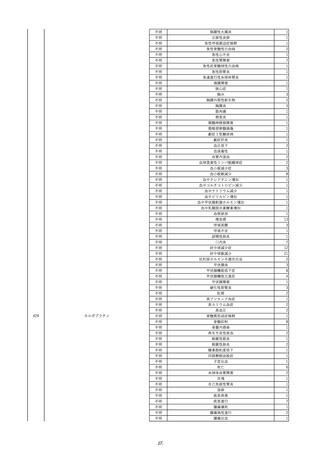
報告受領日
2022/11/28
販売名(一般名)
照射濃厚血小板-LR(人血小板濃厚液
(放射線照射))
患者 年
性別 代
男
原疾患(簡略名)
70 血液腫瘍
感染症名
細菌感染
投与年月
22/11
投与前検査(年月)
輸血開始1時間39分前 BT
36.7℃、BP 115/63 mmHg、HR
78 /min、SpO2 96%。
企業投与前
検査
(年月)
投与後検査(年月)
輸血開始5分後 戦慄あり、悪寒あり。輸血中止。
輸血中止20分後 戦慄軽快。輸血再開。
輸血再開5分後 戦慄なし、発熱なし。
内視鏡検査施行。
輸血再開1時間20分後 戦慄あり。BT 38.1℃、BP 152/65 mmHg、HR 144 /min、SpO2 86%。
ヒドロコルチゾンコハク酸エステルナトリウム 100 mg静脈内投与。O2 カヌラ 3 L/min。
輸血再開1時間35分後 輸血中止。
輸血中止23分後 BT 40.0℃、BP 113/54 mmHg、HR 126 /min、SpO2 94%(O2 3 L/min)。
輸血中止30分後 BT 40℃。
輸血中止2時間後 血液培養検査実施。
輸血中止3時間40分後 BT 38.6℃、BP 94/56 mmHg、HR 103 /min、SpO2 95%。
輸血中止3時間50分後 BT 38.6℃。
企業投与後
検査
(年月)
受血者個別NAT
献血者個別NAT
調査中
-
-
調査中
-
-
調査中
調査中
-
-
-
-
備考
輸血翌日 BT 36.9℃、BP 68/35 mmHg、HR 68 /min、SpO2 97%。
セフトリアキソンナトリウム水和物 2 g/日投与開始。
バイタル測定5時間53分後 BT 36.7℃、BP 109/60 mmHg、HR 68 /min、SpO2 98%。
バイタル測定6時間後 胸部X線検査にて、浸潤影なし。心拡大なし。
輸血5日後 院内にて実施の患者血液培養検査は陰性。
輸血41日前 心エコーにて、心機
能良好。
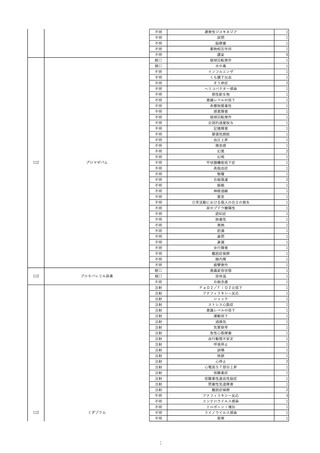
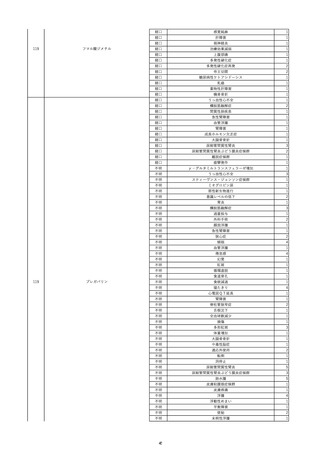
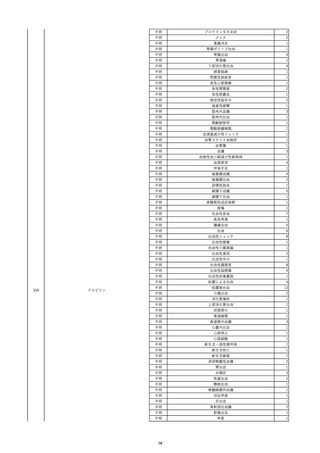
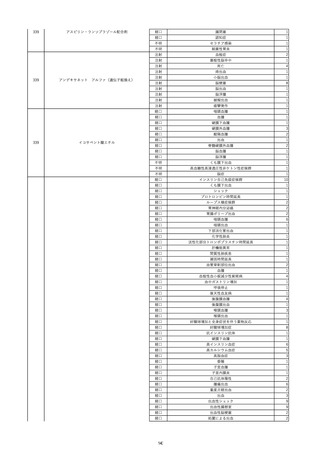
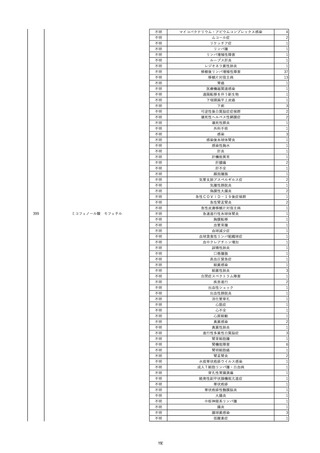
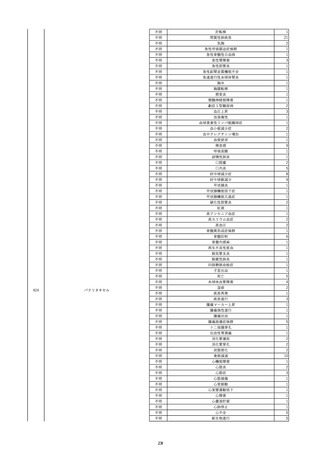
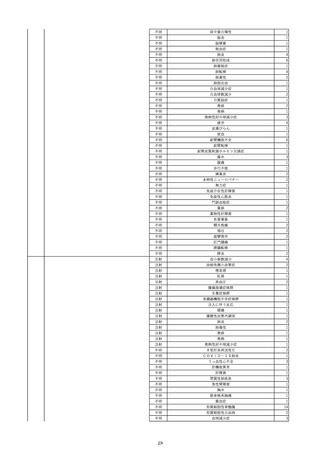
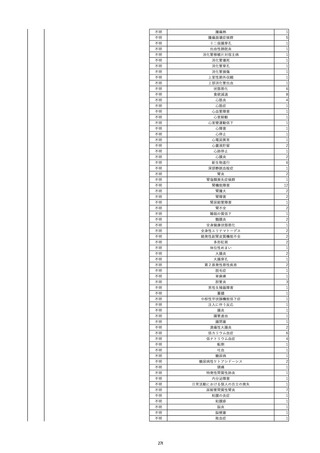
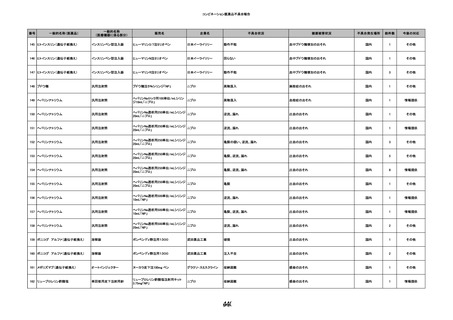
16
2022/11/28
照射赤血球液-LR(人赤血球液(放射線
男
照射))
70
循環器疾患
循環器疾患
細菌感染
22/11
輸血開始20分後 徐々に頻脈あり。
輸血2日前 胸部CTにて、両側少 輸血開始1時間9分後 HR 121 /min。ノルアドレナリン開始。
量胸水あり。腹水中等量あり。
輸血開始1時間13分後 血液ガス検査にて、pH 7.523、PaO2 52.7 mmHg、PaCO2 29.4 mmHg、SaO2 91.1%(人工呼吸 FiO2 35%)。P/F比 151。
輸血開始1時間15分後 BT 38.5℃、BP 92/39 mmHg、HR 126 /min、SpO2 96%(人工呼吸 FiO2 45%)。
輸血前日 胸部聴診にて、異常な 輸血開始2時間後 輸血終了。
し。
輸血終了3分後 頻脈性心房細動あり。BP 57/31 mmHg。顔面紅潮あり。
胸部聴診3時間32分後 血液ガス 輸血終了16分後 メチルプレドニゾロンコハク酸エステルナトリウム投与。
検査にて、pH 7.460、PaO2 71.5 以降頻脈継続。多量の昇圧剤使用も反応乏しい。
mmHg、PaCO2 36.5 mmHg、
輸血終了40分後 BT 37.2℃、BP 75/36 mmHg、HR 119 /min、SpO2 93%(人工呼吸 FiO2 55%)。
SaO2 95.9%(人工呼吸 FiO2
輸血終了43分後 血液ガス検査にて、pH 7.509、PaO2 51.4 mmHg、PaCO2 26.8 mmHg、SaO2 90.3%(人工呼吸 FiO2 45%)。P/F比 114。
30%)。P/F比 238。
輸血終了1時間2分後 血液培養検査実施。
輸血量+輸液量 4648 mL、尿量 輸血終了1時間53分後 血液ガス検査にて、pH 7.455、PaO2 44.2 mmHg、PaCO2 28.3 mmHg、SaO2 82.6%(人工呼吸 FiO2 80%)。P/F比 55.2。
661 mL。
輸血終了1時間56後 BT 37.6℃、BP 71/33 mmHg、HR 136 /min、SpO2 92%(人工呼吸 FiO2 100%)。
輸血終了2時間9分後 胸部聴診にて、両側エア入り不良。胸部X線検査にて、両側性浸潤影あり。心拡大あり(CTR 56.4%)。肺水腫。右上葉無気肺。
輸血当日
輸血終了2時間10分後 CVP 10 mmHg。
輸血前臨床的心不全なし。
輸血終了2時間17分後 白血球数著減。敗血症性ショックと判断。
輸血開始2時間2分前 胸部X線検 輸血終了3時間13分後 血液ガス検査にて、pH 7.294、PaO2 49.4 mmHg、PaCO2 32.0 mmHg、SaO2 80.5%(人工呼吸 FiO2 100%)。P/F比 49.4。
査にて、片側性浸潤影あり。心拡 輸血終了3時間17分後 BT 36.5℃、BP 90/42 mmHg、HR 124 /min、SpO2 81%(人工呼吸 FiO2 100%)。
大あり(CTR 56.7%)。
輸血終了4時間2分後 血液ガス検査にて、pH 7.165、PaO2 53.1 mmHg、PaCO2 42.6 mmHg、SaO2 77.4%(人工呼吸 FiO2 100%)。P/F比 53.1。
輸血開始1時間40分前 血液ガス 輸血終了5時間4分後 血液ガス検査にて、pH 7.191、PaO2 59.5 mmHg、PaCO2 45.0 mmHg、SaO2 84.4%(人工呼吸 FiO2 100%)。P/F比 59.5。
検査にて、pH 7.471、PaO2 71.8 輸血終了6時間41分後 血液ガス検査にて、pH 7.106、PaO2 52.0 mmHg、PaCO2 48.4 mmHg、SaO2 75.2%(人工呼吸 FiO2 100%)。P/F比 52.0。
mmHg、PaCO2 34.0 mmHg、
輸血終了8時間37分後 血液ガス検査にて、pH 6.997、PaO2 48.6 mmHg、PaCO2 53.3 mmHg、SaO2 67.6%(人工呼吸 FiO2 100%)。P/F比 48.6。
SaO2 95.9%(人工呼吸 FiO2
輸血終了10時間3分後 敗血症性ショックにて、患者死亡。剖検なし。副作用と死亡との関連性不明。
35%)。P/F比 205。
輸血量+輸液量 5693 mL、尿量 147 mL。
輸血開始1時間20分前 BT
37.4℃、BP 78/41 mmHg、HR 82 輸血5日後 輸血日実施の患者血液培養検査よりPseudomonas aeruginosa 、Enterobacter cloacae を同定。
/min、SpO2 100%(人工呼吸
FiO2 35%)。
HCV-Ab(-)
(13/09)
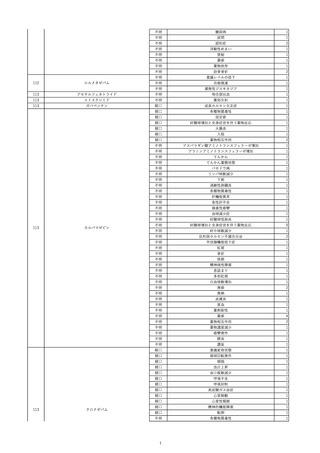
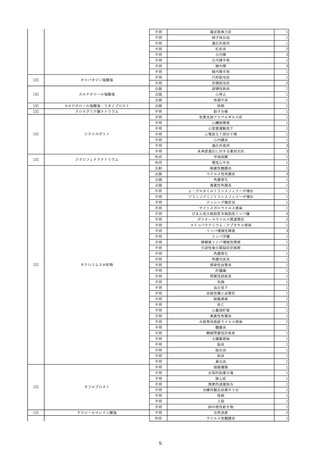
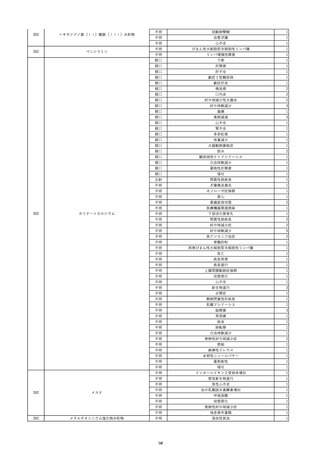
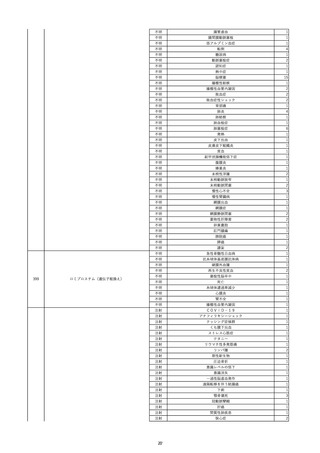
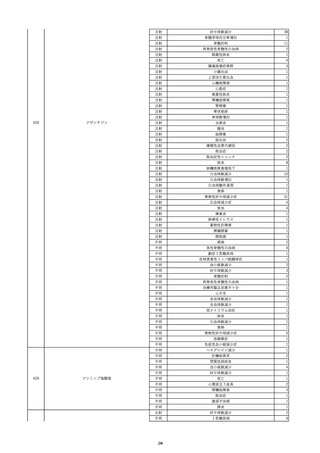
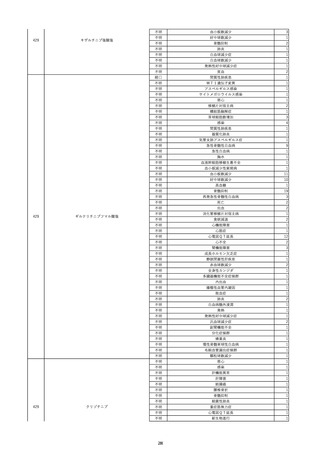
17
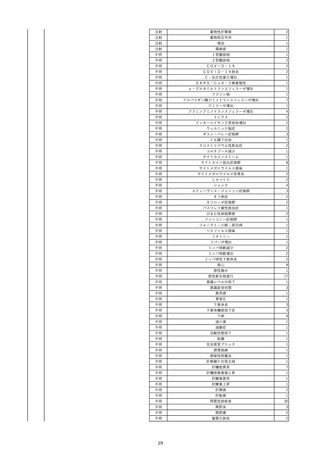
2022/11/29
照射赤血球液-LR(人赤血球液(放射線
男
照射))
90
消化器疾患
糖尿病
C型肝炎
22/10
HCV-Ab(-)
(14/04)
HCV-Ab(-)
(22/10)
HCV-Ab(+)
(22/11)
調査中
調査中
HCV-RNA(+)
(22/11)
輸血開始10分後 股部リンパ節の痛み、白血球増加あり。BT 38℃、HR 77 /min。
18
2022/11/30
照射赤血球液-LR(人赤血球液(放射線
男
照射))
- 血液疾患
細菌感染
22/11
調査中
輸血前 BT 36.7℃、HR 61 /min。 血液培養検査実施できず。
院内にて当該製剤の血液培養検査実施中。
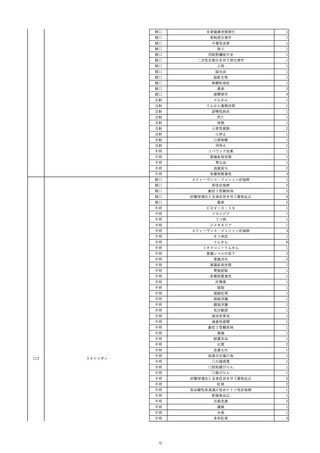
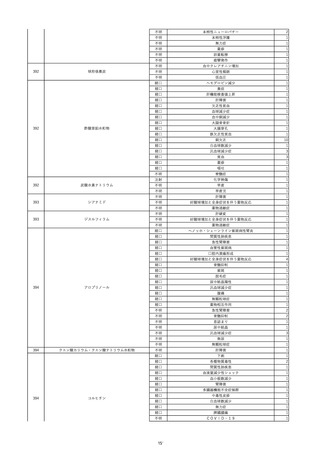
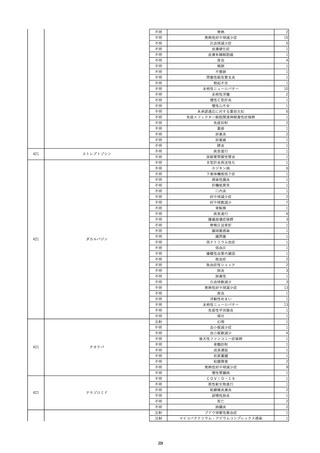
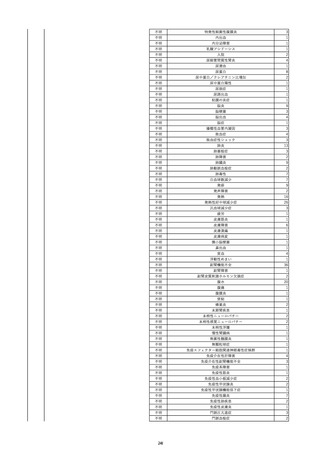
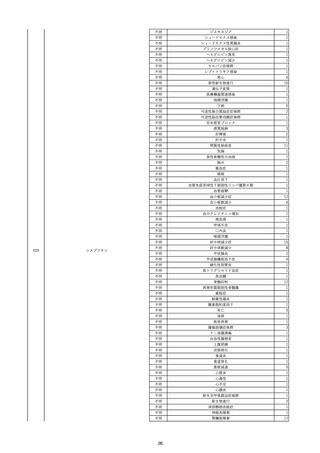
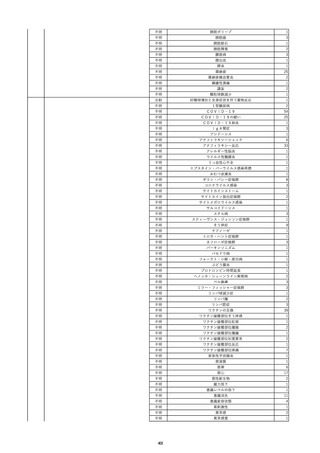
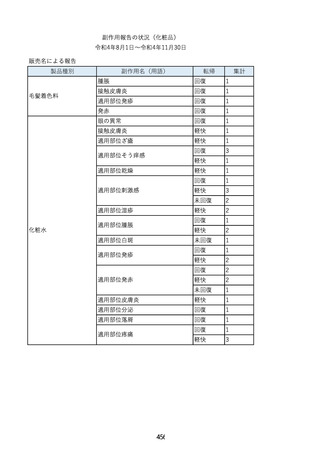
19
20
21
22
23
2022/9/2
コンコエイト-HT(乾燥濃縮人血液凝固第
男
8因子)
2022/9/21 アルブミナー(人血清アルブミン)
2022/9/22 赤十字アルブミン(人血清アルブミン)
フィブロガミンP(ヒト血漿由来乾燥血液凝
固第13因子)
2022/9/28 べリプラストP(フィブリノゲン加第13因子
(2))
タココンブ(フィブリノゲン配合剤(1))
2022/11/9
60 血液疾患
HIV感染
C型肝炎
文献からの情報。
-
C型肝炎ウ
イルス検査 陽性
80 -
男
B型肝炎コ
80 腎・泌尿器系疾患
20/10
ア抗体陽性
コンコエイト-HT(乾燥濃縮人血液凝固第
男
8因子)
60 -
50 血液疾患
先天性血友病Aに対する血液製剤由来のHIV、HCV感染を有していた。
-
-
投与された血液製剤は過去の血液製剤であると考えられ、現在の製剤による感染症報告ではない。
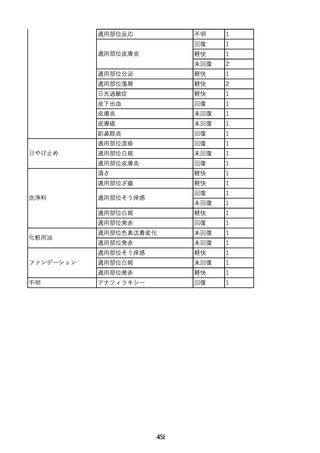
男
男
-
不明日 HCVはマイナスだった。
HBc-Ab陰性。
(20/10)
急性C型肝
01/07
炎
投与19日前 抗HCV抗体陰性。
(01/07)
HIV感染
C型肝炎
B型肝炎
-
本剤投与後、HCVがプラスになった。
(22/08)
-
-
-
-
当該製品の製造工程中には、60℃、10時間液状加熱処理(パスツリゼーション)等のウイルス除去・不活化工程が組み込まれ
ている。
また、製造工程におけるウイルス除去・不活化を確認するために、モデルウイルスを用いたウイルスバリデーション試験を行
い、「血漿分画製剤のウイルス安全対策について」(平成15年11月7日付 厚生労働省医薬食品局 4課長連名通知 第1107001
号)において、ウイルスが十分に除去・不活化されていると判断されたウイルスクリアランス指数9以上が得られることを確認し
ている。
-
-
-
-
以下に、当該製品の製造工程に施しているウイルス対策を示す。
(1) 原料血漿についてHBs抗原検査及び核酸増幅試験(NAT)にてHBV抗原及びHBV-DNAが検出されないことを確認してい
る。
(2) ウイルスの除去・不活化の製造工程としてアルコール分画工程、液状加熱処理を施している。モデルウイルスとしてBVDV
(Bovine viral diarrhea virus)及びPRV(Pseudorabies virus)を用いたウイルスクリアランス試験結果において、それぞれ総ウイ
ルスクリアランス指数≧9.6、≧10.9というLRVを得ている。
(3) 最終製剤で核酸増幅試験(NAT)にてHBV–DNAが検出されないことを確認して出荷している。
-
-
-
-
当該製品の製造工程中には、60℃、10時間液状加熱処理(パスツリゼーション)等のウイルス除去・不活化工程が組み込まれ
ている。
また、製造工程におけるウイルス除去・不活化を確認するために、モデルウイルスを用いたウイルスバリデーション試験を行
い、「血漿分画製剤のウイルス安全対策について」(平成15年11月7日付 厚生労働省医薬食品局 4課長連名通知 第1107001
号)において、ウイルスが十分に除去・不活化されていると判断されたウイルスクリアランス指数9以上が得られることを確認し
ている。
-
-
-
-
HBc-Ab陽性。
(22/09)
PCR検査実施。B型肝炎ウイルス陰性。
(22/09)
投与51日後 抗HCV抗体陰性。
(01/09)
投与56日後 抗HCV抗体及びHCV-PCRは陽性。
(01/09)
文献からの情報。
-
乳児期に血友病Aと診断され、血液製剤によりHIV/HCV/HBVに感染した。
投与された血液製剤は過去の血液製剤であると考えられ、現在の製剤による感染症報告ではない。
462