よむ、つかう、まなぶ。
参考資料2 薬害を学ぼう指導の手引き (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000197733_00006.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 薬害を学び再発を防止するための教育に関する検討会(第22回 3/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【プラス情報】
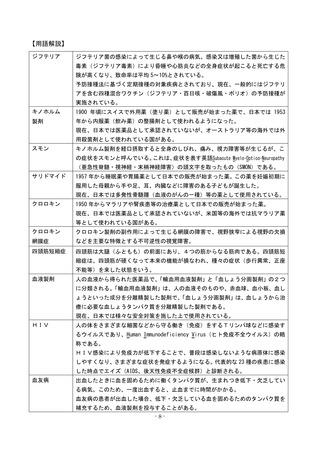
<薬の役割>
まず、病気やけがから回復するときには自然治癒力(病気やけがを乗り切るために、
本来人間が持っている力)が働く。
その上で、薬は、自然治癒力だけでは回復できない場合に、病気の原因を取り除いた
り、自然治癒力を助け、病気やけがが早く治るようにしたり、重くならないようにした
りする役割を果たしている。
<薬の製造から販売まで>
製薬企業が薬を製造、販売するには、医薬品医療機器等法(旧薬事法)に基づき、様々
な審査を得て、医薬品としての承認や製造販売業等の許可を厚生労働大臣から受ける必
要がある。
新薬の承認では、基礎研究、非臨床試験(動物実験)、臨床試験(治験)などのデー
タに基づき、独立行政法人医薬品医療機器総合機構(PMDA)で審査がなされ、学識
経験者の集まる薬事・食品衛生審議会の意見を踏まえて厚生労働大臣が承認する。
薬の承認後には、製薬企業は安全性情報を報告する義務が課されるとともに、一部の
薬には再審査、再評価が課される場合もある。
製薬会社による研究開発
厳 格 な ルー ルを 遵 守 し
た製造 により、安 全 性、
品質の確保
基礎研究 2~3年
(将来薬となる可能性のある新しい物質を発見したり作り出す)
非臨床試験 3~5年
(動物や培養細胞を用いて有効性と安全性を研究する)
臨床試験(治験) 3~7年
(安全で実際にヒトに効果があるかどうかを最終的に調べる)
承認申請
独立行政法人医薬品医療機器総合機構による承認審査
(薬学、医学、獣医学などの専門知識を有する審査員がチームで審査)
厚生労働省薬事・食品衛生審議会による審査
(学識経験者による審査)
製造・販売
販売時にすべての情報が揃っているわけではないので、事後的に情報
を収集し、医療従事者等に提供するさまざまな仕組みが整備されている
再審査
(市販後一定期間が経過し
た薬について、実際の使用
状況を 見て 改めて 効 能や
有効性を審査する制度)
-6-
再評価
(再審査の終了した薬等につ
いて、現時点での医学・薬学
の学問水準に照らして品質や
有効性などを評価する制度)
etc.
<薬の役割>
まず、病気やけがから回復するときには自然治癒力(病気やけがを乗り切るために、
本来人間が持っている力)が働く。
その上で、薬は、自然治癒力だけでは回復できない場合に、病気の原因を取り除いた
り、自然治癒力を助け、病気やけがが早く治るようにしたり、重くならないようにした
りする役割を果たしている。
<薬の製造から販売まで>
製薬企業が薬を製造、販売するには、医薬品医療機器等法(旧薬事法)に基づき、様々
な審査を得て、医薬品としての承認や製造販売業等の許可を厚生労働大臣から受ける必
要がある。
新薬の承認では、基礎研究、非臨床試験(動物実験)、臨床試験(治験)などのデー
タに基づき、独立行政法人医薬品医療機器総合機構(PMDA)で審査がなされ、学識
経験者の集まる薬事・食品衛生審議会の意見を踏まえて厚生労働大臣が承認する。
薬の承認後には、製薬企業は安全性情報を報告する義務が課されるとともに、一部の
薬には再審査、再評価が課される場合もある。
製薬会社による研究開発
厳 格 な ルー ルを 遵 守 し
た製造 により、安 全 性、
品質の確保
基礎研究 2~3年
(将来薬となる可能性のある新しい物質を発見したり作り出す)
非臨床試験 3~5年
(動物や培養細胞を用いて有効性と安全性を研究する)
臨床試験(治験) 3~7年
(安全で実際にヒトに効果があるかどうかを最終的に調べる)
承認申請
独立行政法人医薬品医療機器総合機構による承認審査
(薬学、医学、獣医学などの専門知識を有する審査員がチームで審査)
厚生労働省薬事・食品衛生審議会による審査
(学識経験者による審査)
製造・販売
販売時にすべての情報が揃っているわけではないので、事後的に情報
を収集し、医療従事者等に提供するさまざまな仕組みが整備されている
再審査
(市販後一定期間が経過し
た薬について、実際の使用
状況を 見て 改めて 効 能や
有効性を審査する制度)
-6-
再評価
(再審査の終了した薬等につ
いて、現時点での医学・薬学
の学問水準に照らして品質や
有効性などを評価する制度)
etc.