よむ、つかう、まなぶ。
【資料1】検討会開催の背景と進め方 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
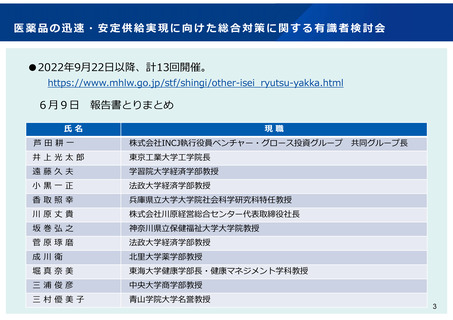
検討事項の概要
開発促進
市販後安全対策
▍希少疾病用医薬品の指定のあり方
日本の希少疾病用医薬品の指定時期が欧米よりも遅く、指定
数が少ない現状を踏まえ、開発の早期段階で広範に指定でき
るよう、運用の見直しを検討
▍製造販売後に実施する使用成績調査等のあり方
新薬の製造販売後に行われる安全性監視活動として、多くの
場合、使用成績調査(全例調査を含む。)が行われているが、
製薬企業の実施負担が大きいとの指摘も踏まえ、製造販売後
の情報収集のあり方について検討
▍小児用医薬品の開発促進に資する薬事審査等のあり方
製薬企業に小児用医薬品の開発を促すため、成人用を開発す
る段階で、製薬企業に小児用医薬品の開発計画の策定を促す
ための方策を検討
臨床試験
▍薬事制度におけるリアルワールドデータの活用のあり方
リアルワールドデータの利活用に向けた環境整備が進みつつ
ある現状を踏まえ、その薬事制度における活用のあり方につ
いて検討
品質
▍我が国の承認審査における日本人データの必要性の整理
海外で早期の臨床試験が実施された薬剤について、第3相試
験等の国際共同治験の段階から日本が参加する場合における
日本人の安全性の確認の考え方を整理(第Ⅰ相試験の要否を
含む。)
▍医薬品の製造方法に係る薬事審査等のあり方
医薬品の承認書における製造方法の記載や変更管理のあり方
について、国際整合性も考慮しつつ検討
希少疾患等に用いる薬剤であって、外国においてのみ検証的
な臨床試験が実施されている場合における薬事承認の考え方
を整理
情報発信
▍治験の更なる効率化(エコシステム)の導入
日本での治験実施が高コストである現状を踏まえ、GCPの観
点から更なる効率化に寄与する運用の見直しを検討
▍我が国の薬事制度に関する海外への情報発信
海外ベンチャー企業が日本での開発を行わない背景の一つと
して、日本の薬事制度に関する理解不足や誤解がある背景を
踏まえ、海外への情報発信のあり方について検討
11
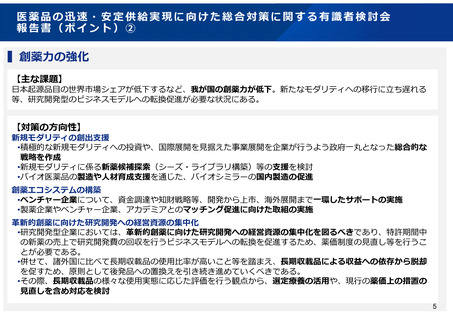
開発促進
市販後安全対策
▍希少疾病用医薬品の指定のあり方
日本の希少疾病用医薬品の指定時期が欧米よりも遅く、指定
数が少ない現状を踏まえ、開発の早期段階で広範に指定でき
るよう、運用の見直しを検討
▍製造販売後に実施する使用成績調査等のあり方
新薬の製造販売後に行われる安全性監視活動として、多くの
場合、使用成績調査(全例調査を含む。)が行われているが、
製薬企業の実施負担が大きいとの指摘も踏まえ、製造販売後
の情報収集のあり方について検討
▍小児用医薬品の開発促進に資する薬事審査等のあり方
製薬企業に小児用医薬品の開発を促すため、成人用を開発す
る段階で、製薬企業に小児用医薬品の開発計画の策定を促す
ための方策を検討
臨床試験
▍薬事制度におけるリアルワールドデータの活用のあり方
リアルワールドデータの利活用に向けた環境整備が進みつつ
ある現状を踏まえ、その薬事制度における活用のあり方につ
いて検討
品質
▍我が国の承認審査における日本人データの必要性の整理
海外で早期の臨床試験が実施された薬剤について、第3相試
験等の国際共同治験の段階から日本が参加する場合における
日本人の安全性の確認の考え方を整理(第Ⅰ相試験の要否を
含む。)
▍医薬品の製造方法に係る薬事審査等のあり方
医薬品の承認書における製造方法の記載や変更管理のあり方
について、国際整合性も考慮しつつ検討
希少疾患等に用いる薬剤であって、外国においてのみ検証的
な臨床試験が実施されている場合における薬事承認の考え方
を整理
情報発信
▍治験の更なる効率化(エコシステム)の導入
日本での治験実施が高コストである現状を踏まえ、GCPの観
点から更なる効率化に寄与する運用の見直しを検討
▍我が国の薬事制度に関する海外への情報発信
海外ベンチャー企業が日本での開発を行わない背景の一つと
して、日本の薬事制度に関する理解不足や誤解がある背景を
踏まえ、海外への情報発信のあり方について検討
11