よむ、つかう、まなぶ。
【資料1】検討会開催の背景と進め方 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
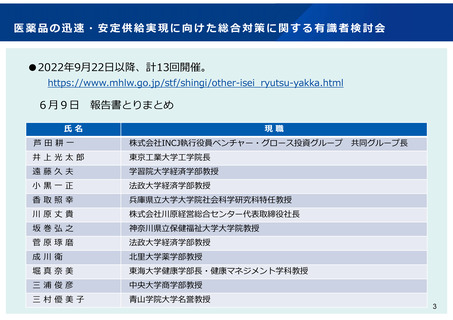
医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会
報告書(ポイント)③
▍ドラッグ・ラグ/ドラッグ・ロスの解消
【主な課題】
欧米では承認されている143品目が日本で未承認。うち、国内開発未着手のものが86品目あり、ドラッグ・ロスが
懸念される。開発未着手品目は、ベンチャー企業発、希少疾患用医薬品、小児用医薬品の割合が多い。
【対策の方向性】
革新的医薬品の迅速導入に向けた環境の整備
• 国際共同治験への対応の強化。特に、国際共同治験に参加するための日本人データの要否等、薬事承認における
日本人データの必要性を整理
• 希少疾病用医薬品指定制度について、早期段階から指定できるよう制度を見直し
• 小児用医薬品の開発計画策定の促進や、新たなインセンティブを検討
• 海外ベンチャー等に対し、日本の制度を伝達
現に発生しているドラッグ・ラグ/ドラッグ・ロスへの対応強化
• AMED研究事業による支援により、先進医療・患者申出療養等による治療の早期実施が可能な体制の構築
日本市場の魅力を向上させる薬価制度
• 新規モダリティなどの革新的医薬品についての新たな評価方法を検討
• 医療上特に必要な革新的医薬品の迅速導入に向けた新たなインセンティブを検討
• ベンチャー発品目の新薬創出等加算における適切な評価の在り方を検討
• 医療上特に必要な革新的医薬品について、特許期間中の薬価維持の仕組みの強化を検討
• 市場拡大再算定について、再算定の対象となる類似品の考え方の見直しを検討
• 医療保険財政への影響を考慮しメリハリをつけた対応などを検討
※上記の薬価上の措置は創薬力に係る対策の方向性も兼ねている
6
報告書(ポイント)③
▍ドラッグ・ラグ/ドラッグ・ロスの解消
【主な課題】
欧米では承認されている143品目が日本で未承認。うち、国内開発未着手のものが86品目あり、ドラッグ・ロスが
懸念される。開発未着手品目は、ベンチャー企業発、希少疾患用医薬品、小児用医薬品の割合が多い。
【対策の方向性】
革新的医薬品の迅速導入に向けた環境の整備
• 国際共同治験への対応の強化。特に、国際共同治験に参加するための日本人データの要否等、薬事承認における
日本人データの必要性を整理
• 希少疾病用医薬品指定制度について、早期段階から指定できるよう制度を見直し
• 小児用医薬品の開発計画策定の促進や、新たなインセンティブを検討
• 海外ベンチャー等に対し、日本の制度を伝達
現に発生しているドラッグ・ラグ/ドラッグ・ロスへの対応強化
• AMED研究事業による支援により、先進医療・患者申出療養等による治療の早期実施が可能な体制の構築
日本市場の魅力を向上させる薬価制度
• 新規モダリティなどの革新的医薬品についての新たな評価方法を検討
• 医療上特に必要な革新的医薬品の迅速導入に向けた新たなインセンティブを検討
• ベンチャー発品目の新薬創出等加算における適切な評価の在り方を検討
• 医療上特に必要な革新的医薬品について、特許期間中の薬価維持の仕組みの強化を検討
• 市場拡大再算定について、再算定の対象となる類似品の考え方の見直しを検討
• 医療保険財政への影響を考慮しメリハリをつけた対応などを検討
※上記の薬価上の措置は創薬力に係る対策の方向性も兼ねている
6