よむ、つかう、まなぶ。
【資料1】検討会開催の背景と進め方 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
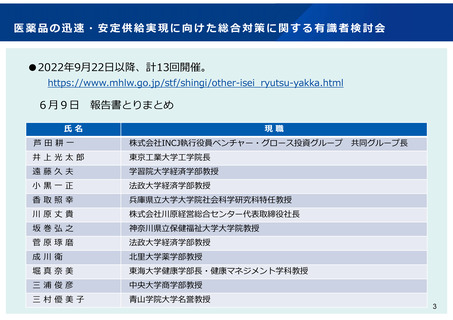
医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会
報告書抜粋(薬事規制関係)
第2章 医薬品の迅速・安定供給実現に向けた対策の方向
2.1 医薬品の安定供給の確保に向けて
2.1.1 後発品産業構造の見直し
(医薬品の安定供給の確保に向けた政府による基盤整備)
○ また、各製造所において製造効率の向上と品質確保の両立が図れるよう、異業種におけるノウハウの活用について検討すると
ともに、迅速な薬事承認を可能とする体制の確保や変更手続のあり方を明確化することで、製造効率の向上に向けた企業マインド
を醸成することについても検討すべきである。
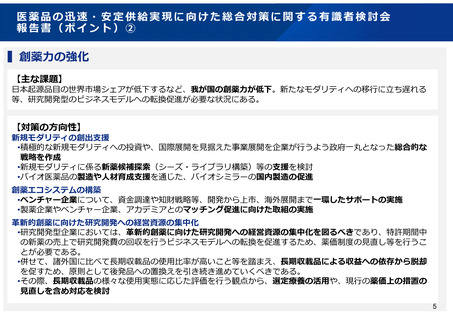
2.2 創薬力の強化、ドラッグ・ラグ/ドラッグ・ロスの解消
2.2.2 ドラッグ・ラグ/ドラッグ・ロスの解消
(国際共同治験の推進や治験環境の整備)
○ 現在は、日本の治験パフォーマンスが海外に比べて低いという状況であり、特に、国際共同治験においては、日本人症例の組入
れが遅いといった理由で、日本を避けるという意見もある。グローバルから選ばれる国になるためにも、政府が中心となって国際
的なポジションを高めることが必要であり、国際共同治験の国内治験実施施設における国際対応力を強化するとともに、国際共同
治験に参加するための日本人データの要否など、薬事承認制度における日本人データの必要性を整理すべきである。
(薬事関係)
○ モダリティの変化などの技術革新、創薬環境や産業構造の変化等を的確に捉えるとともに、製薬企業が日本での開発を行わない
現状を認識し、医薬品の有効性及び安全性を適切に評価しつつ、迅速な開発に資するよう、レギュラトリーサイエンスに基づき薬
事制度の在るべき姿を検討すべきである。
○ 日本の希少疾病用医薬品指定制度が欧米よりも指定時期が遅いことから、欧米に比べ、その指定数が少ない現状を踏まえ、開発
の早期段階で指定できるよう、運用の見直しを検討するとともに、そのために必要なPMDA の体制を整備すべきである。
○ 製薬企業に小児用医薬品の開発を促すため、成人用を開発する段階で、製薬企業に小児用医薬品の開発計画の策定を促すととも
に、開発に当たって、新規インセンティブを検討すべきである。
(海外へのプロアクティブな情報発信)
○ 既存のベンチャー相談支援事業の海外向け PR や遠隔相談の実施、PMDA による英語での情報発信や相談などの取組を実施し、
日本の制度を海外に正しく伝達することが必要である。
8
報告書抜粋(薬事規制関係)
第2章 医薬品の迅速・安定供給実現に向けた対策の方向
2.1 医薬品の安定供給の確保に向けて
2.1.1 後発品産業構造の見直し
(医薬品の安定供給の確保に向けた政府による基盤整備)
○ また、各製造所において製造効率の向上と品質確保の両立が図れるよう、異業種におけるノウハウの活用について検討すると
ともに、迅速な薬事承認を可能とする体制の確保や変更手続のあり方を明確化することで、製造効率の向上に向けた企業マインド
を醸成することについても検討すべきである。
2.2 創薬力の強化、ドラッグ・ラグ/ドラッグ・ロスの解消
2.2.2 ドラッグ・ラグ/ドラッグ・ロスの解消
(国際共同治験の推進や治験環境の整備)
○ 現在は、日本の治験パフォーマンスが海外に比べて低いという状況であり、特に、国際共同治験においては、日本人症例の組入
れが遅いといった理由で、日本を避けるという意見もある。グローバルから選ばれる国になるためにも、政府が中心となって国際
的なポジションを高めることが必要であり、国際共同治験の国内治験実施施設における国際対応力を強化するとともに、国際共同
治験に参加するための日本人データの要否など、薬事承認制度における日本人データの必要性を整理すべきである。
(薬事関係)
○ モダリティの変化などの技術革新、創薬環境や産業構造の変化等を的確に捉えるとともに、製薬企業が日本での開発を行わない
現状を認識し、医薬品の有効性及び安全性を適切に評価しつつ、迅速な開発に資するよう、レギュラトリーサイエンスに基づき薬
事制度の在るべき姿を検討すべきである。
○ 日本の希少疾病用医薬品指定制度が欧米よりも指定時期が遅いことから、欧米に比べ、その指定数が少ない現状を踏まえ、開発
の早期段階で指定できるよう、運用の見直しを検討するとともに、そのために必要なPMDA の体制を整備すべきである。
○ 製薬企業に小児用医薬品の開発を促すため、成人用を開発する段階で、製薬企業に小児用医薬品の開発計画の策定を促すととも
に、開発に当たって、新規インセンティブを検討すべきである。
(海外へのプロアクティブな情報発信)
○ 既存のベンチャー相談支援事業の海外向け PR や遠隔相談の実施、PMDA による英語での情報発信や相談などの取組を実施し、
日本の制度を海外に正しく伝達することが必要である。
8