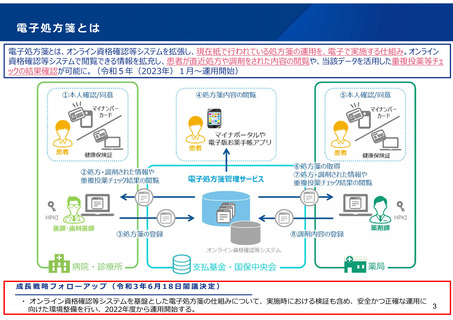
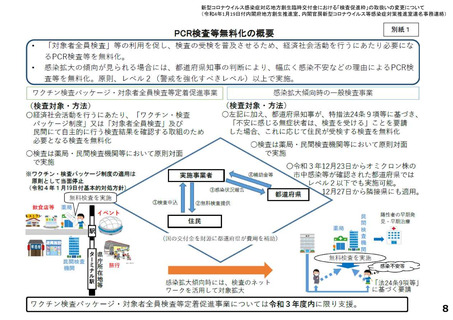
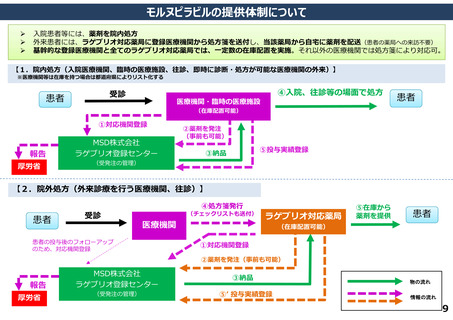
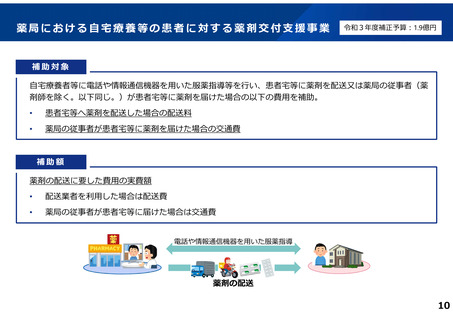
よむ、つかう、まなぶ。
参考資料 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_23980.html |
| 出典情報 | 全国薬務関係主管課長会議(令和3年度 3/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
緊急時の薬事承認の在り方等に関するとりまとめ(概要)
○ 骨太の方針2021等を踏まえ、令和3年11月より厚生科学審議会医薬品医療機器制度部会において感染症等に対する我が国の
危機管理強化に向けた緊急時の薬事承認の在り方について議論を開始し、同年12月に「緊急時の薬事承認制度」の概要をとりまとめ
た。今後、当該とりまとめを踏まえ、所要の法整備を早急に行っていく。
緊急時の薬事承認制度の概要
1)緊急承認制度の対象
○ ワクチンや治療薬だけでなく、医薬品全般、医療機器及び再生
医療等製品等も制度の対象
2)発動の要件
○
国民の生命及び健康に重大な影響を与えるおそれがある疾病のま
ん延その他の健康被害の拡大を防止するために緊急に使用される
ことが必要な医薬品等であり、他に代替手段が存在しないこと
○ 緊急時の消失等、状況の変化があれば、有効性・安全性のバラン
スを継続的に確認し、必要があれば、承認の期限前であっても承
認内容の変更や取り消し等を実施可能
3)運用の基準
○
○
安全性は通常の薬事承認と同等の水準で確認することを前提
有効性は、例えば、緊急時に暇がなく、検証的臨床試験が完了
していない場合でも、入手可能な臨床試験の試験成績から、有効
性が推定されれば、承認可能
○ 承認に当たっては、薬事・食品衛生審議会から意見を聴取(軽
微な変更を除く。)
4)承認の期限・条件
○
緊急時であることを踏まえ、承認に当たって付与する期限は短
期間としつつ、期限内に改めて有効性等の確認を求める。必要に
応じて期限の延長が可能 ※過去の大規模感染症の収束は概ね2年
○ 必要な条件を付与(有効性等に関するデータの収集、保健衛生
上必要な措置等)有効性等が確認されなければ、承認を取り消し
5)市販後の安全対策
○
緊急承認された医薬品医療機器等の特性に応じたリスク管理計画等におい
て、安全性監視計画等を設定し、リスク最小化計画を設定
○ 高頻度な審議会の開催等により、専門家の評価も踏まえつつ、安全対策を
実施
○ これまでの個別事例の因果関係評価に基づいた安全対策に加え、リアル
ワールドデータの活用や、集積する事例を統計的に解析した上での安全対
策の実施
6)健康被害の救済
○ 安全性は通常の薬事承認と同等の水準で確認することを前提としているた
め、医薬品副作用被害救済制度等の対象とし、健康被害を救済
○ 健康被害が発生した場合には、迅速な健康被害の救済に向け、所要の手続
を速やかに進める必要
7)迅速化のための特例措置
○ GMP調査、国家検定、容器包装等を承認の要件とはしないものの、必要に
応じて、緊急承認審査中又はその承認後であっても、これらの調査を実施
8)その他
○
緊急時の生産体制の整備や、新型コロナワクチンの国主導で流通を管理し
ていたことを踏まえ、必要な医薬品等が迅速に国民に行き渡るよう、状況
に応じた適切な対応が重要
1
○ 骨太の方針2021等を踏まえ、令和3年11月より厚生科学審議会医薬品医療機器制度部会において感染症等に対する我が国の
危機管理強化に向けた緊急時の薬事承認の在り方について議論を開始し、同年12月に「緊急時の薬事承認制度」の概要をとりまとめ
た。今後、当該とりまとめを踏まえ、所要の法整備を早急に行っていく。
緊急時の薬事承認制度の概要
1)緊急承認制度の対象
○ ワクチンや治療薬だけでなく、医薬品全般、医療機器及び再生
医療等製品等も制度の対象
2)発動の要件
○
国民の生命及び健康に重大な影響を与えるおそれがある疾病のま
ん延その他の健康被害の拡大を防止するために緊急に使用される
ことが必要な医薬品等であり、他に代替手段が存在しないこと
○ 緊急時の消失等、状況の変化があれば、有効性・安全性のバラン
スを継続的に確認し、必要があれば、承認の期限前であっても承
認内容の変更や取り消し等を実施可能
3)運用の基準
○
○
安全性は通常の薬事承認と同等の水準で確認することを前提
有効性は、例えば、緊急時に暇がなく、検証的臨床試験が完了
していない場合でも、入手可能な臨床試験の試験成績から、有効
性が推定されれば、承認可能
○ 承認に当たっては、薬事・食品衛生審議会から意見を聴取(軽
微な変更を除く。)
4)承認の期限・条件
○
緊急時であることを踏まえ、承認に当たって付与する期限は短
期間としつつ、期限内に改めて有効性等の確認を求める。必要に
応じて期限の延長が可能 ※過去の大規模感染症の収束は概ね2年
○ 必要な条件を付与(有効性等に関するデータの収集、保健衛生
上必要な措置等)有効性等が確認されなければ、承認を取り消し
5)市販後の安全対策
○
緊急承認された医薬品医療機器等の特性に応じたリスク管理計画等におい
て、安全性監視計画等を設定し、リスク最小化計画を設定
○ 高頻度な審議会の開催等により、専門家の評価も踏まえつつ、安全対策を
実施
○ これまでの個別事例の因果関係評価に基づいた安全対策に加え、リアル
ワールドデータの活用や、集積する事例を統計的に解析した上での安全対
策の実施
6)健康被害の救済
○ 安全性は通常の薬事承認と同等の水準で確認することを前提としているた
め、医薬品副作用被害救済制度等の対象とし、健康被害を救済
○ 健康被害が発生した場合には、迅速な健康被害の救済に向け、所要の手続
を速やかに進める必要
7)迅速化のための特例措置
○ GMP調査、国家検定、容器包装等を承認の要件とはしないものの、必要に
応じて、緊急承認審査中又はその承認後であっても、これらの調査を実施
8)その他
○
緊急時の生産体制の整備や、新型コロナワクチンの国主導で流通を管理し
ていたことを踏まえ、必要な医薬品等が迅速に国民に行き渡るよう、状況
に応じた適切な対応が重要
1