よむ、つかう、まなぶ。
【資料3】今後の進め方(案) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37715.html |
| 出典情報 | 医療用医薬品の安定確保策に関する関係者会議(第10回 2/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第8回後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会(資料4)
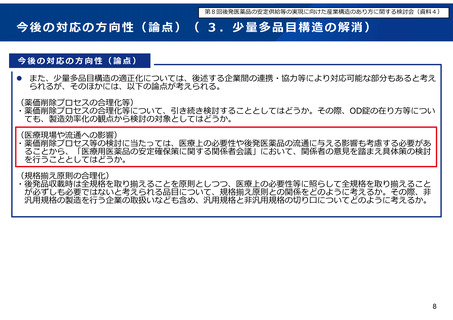
今後の対応の方向性(論点)( 3.少量多品目構造の解消)
今後の対応の方向性(論点)
後発品企業においては、多くの企業が新規後発品を上市し、1社あたりの製造販売品目数が多品目となり、少量
多品目生産が広がっており、こうした少量多品目生産においては、製造工程の複雑化に伴う製造の非効率や、生
産管理体制のリソース不足、品質不良リスクの増大、緊急増産等の柔軟な対応が困難であることなどのデメリッ
トがあることや、収益性の低下にもつながっていることが指摘されている。
後発品業界全体の供給不安のひとつの要因と考えられる少量多品目構造の適正化に向け、「中間取りまとめ」
(次頁)の内容を踏まえ、以下の対応を行うこととしている。
(薬価上の措置、薬事上の障壁解消等)
・令和6年度薬価制度改革において、後発品の新規収載時の薬価算定における、同時に収載される内用薬が10品目
を超える場合に先発品の0.4掛けとする規定について、同時に収載される内用薬が7品目を超える場合に先発品の
0.4掛けとすることとする(令和6年4月から運用開始予定)。
・後発品の新規収載時に安定供給に係る責任者の指定を求めるとともに、収載後の各品目の供給実績の確認を実施
する。(令和6年度の後発品新規収載から運用開始予定)
・製造方法等の変更管理における薬事手続において、欧米と同様の中等度変更事項及び年次報告を試行的に導入す
ることとしており(令和5年10月「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討
会」決定)、製造方法等の記載事項に係る通知の改正について、国際的に整合したリスクベースの変更管理が実
現できるよう検討を進めている(令和6年度内に試行開始予定)。
6
今後の対応の方向性(論点)( 3.少量多品目構造の解消)
今後の対応の方向性(論点)
後発品企業においては、多くの企業が新規後発品を上市し、1社あたりの製造販売品目数が多品目となり、少量
多品目生産が広がっており、こうした少量多品目生産においては、製造工程の複雑化に伴う製造の非効率や、生
産管理体制のリソース不足、品質不良リスクの増大、緊急増産等の柔軟な対応が困難であることなどのデメリッ
トがあることや、収益性の低下にもつながっていることが指摘されている。
後発品業界全体の供給不安のひとつの要因と考えられる少量多品目構造の適正化に向け、「中間取りまとめ」
(次頁)の内容を踏まえ、以下の対応を行うこととしている。
(薬価上の措置、薬事上の障壁解消等)
・令和6年度薬価制度改革において、後発品の新規収載時の薬価算定における、同時に収載される内用薬が10品目
を超える場合に先発品の0.4掛けとする規定について、同時に収載される内用薬が7品目を超える場合に先発品の
0.4掛けとすることとする(令和6年4月から運用開始予定)。
・後発品の新規収載時に安定供給に係る責任者の指定を求めるとともに、収載後の各品目の供給実績の確認を実施
する。(令和6年度の後発品新規収載から運用開始予定)
・製造方法等の変更管理における薬事手続において、欧米と同様の中等度変更事項及び年次報告を試行的に導入す
ることとしており(令和5年10月「創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討
会」決定)、製造方法等の記載事項に係る通知の改正について、国際的に整合したリスクベースの変更管理が実
現できるよう検討を進めている(令和6年度内に試行開始予定)。
6