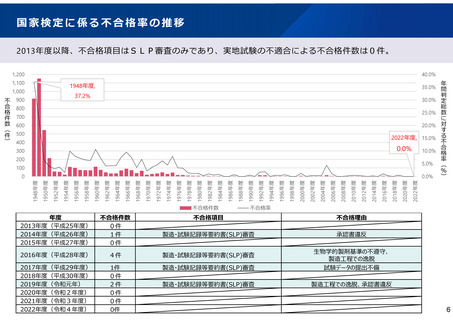
よむ、つかう、まなぶ。
資 料4-2 国家検定実施方法の見直しについて (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37870.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 血液事業部会(令和5年度第4回 2/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
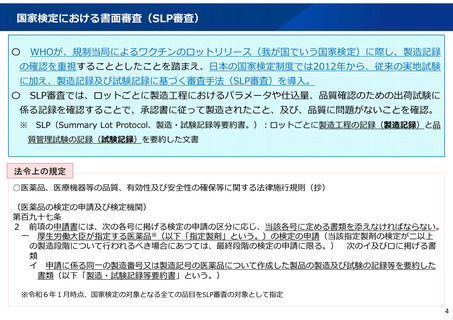
国家検定の実施機関の見直しについて
見直しの方向性
•
国立健康危機管理研究機構(新機構)は従来国家検定を実施し、実地試験や病原体研究に高度の専門性を
有している一方、PMDAは医薬品(ワクチンを含む。)の承認審査やGMP調査等を担当しており、書面に
よる審査や製造・試験記録の確認に専門性を有している。ただし、PMDAは試験設備を持たないため実地
試験の実施は困難であり、また、実地試験が必要な場合、現時点で新機構以外に知見を有する機関はない。
•
新機構についてはワクチンや治療薬の研究などの、より専門性の高い業務に専念することが求められてい
るところ、PMDAが書面審査を担当することで、新機構においては、国家検定業務のうち新機構の高度な
専門性が必要な実地試験業務に専念することが可能となり、研究開発力の強化に繋がる。
•
ついては、ワクチンの国家検定制度については、新機構からPMDAに移管し、PMDAが書面審査をしつつ
も、実地試験が必要な品目の実地試験は引き続き新機構が実施する体制とすることで、両機関の専門性を
活かした、より効率的かつ効果的な検定が可能である。
対応
•
国家検定の実施機関については、新機構の設立に伴い、令和7年4月以降、以下の見直しを行う。
書面審査を中心とした審査で検定が可能と考えられる品目から、順次、新機構からPMDAに移管。
最終的には、実地試験が必要な品目も含め、全ての検定対象品目がPMDAに移管され、検定機関は
PMDAのみとなる。
PMDA移管後は、引き続き実地試験が必要な品目や、国内外の知見に基づき製品の品質や安全性が疑
われる場合には、PMDAから新機構に実地試験の実施を委託。
9
見直しの方向性
•
国立健康危機管理研究機構(新機構)は従来国家検定を実施し、実地試験や病原体研究に高度の専門性を
有している一方、PMDAは医薬品(ワクチンを含む。)の承認審査やGMP調査等を担当しており、書面に
よる審査や製造・試験記録の確認に専門性を有している。ただし、PMDAは試験設備を持たないため実地
試験の実施は困難であり、また、実地試験が必要な場合、現時点で新機構以外に知見を有する機関はない。
•
新機構についてはワクチンや治療薬の研究などの、より専門性の高い業務に専念することが求められてい
るところ、PMDAが書面審査を担当することで、新機構においては、国家検定業務のうち新機構の高度な
専門性が必要な実地試験業務に専念することが可能となり、研究開発力の強化に繋がる。
•
ついては、ワクチンの国家検定制度については、新機構からPMDAに移管し、PMDAが書面審査をしつつ
も、実地試験が必要な品目の実地試験は引き続き新機構が実施する体制とすることで、両機関の専門性を
活かした、より効率的かつ効果的な検定が可能である。
対応
•
国家検定の実施機関については、新機構の設立に伴い、令和7年4月以降、以下の見直しを行う。
書面審査を中心とした審査で検定が可能と考えられる品目から、順次、新機構からPMDAに移管。
最終的には、実地試験が必要な品目も含め、全ての検定対象品目がPMDAに移管され、検定機関は
PMDAのみとなる。
PMDA移管後は、引き続き実地試験が必要な品目や、国内外の知見に基づき製品の品質や安全性が疑
われる場合には、PMDAから新機構に実地試験の実施を委託。
9