よむ、つかう、まなぶ。
資 料4-2 国家検定実施方法の見直しについて (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37870.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 血液事業部会(令和5年度第4回 2/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
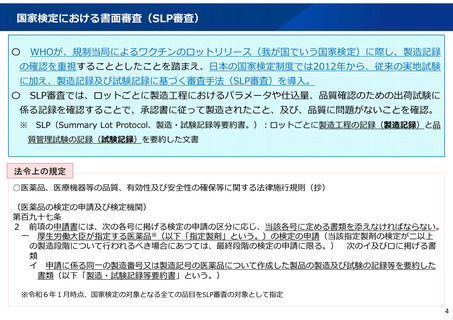
国家検定における書面審査(SLP審査)
〇
WHOが、規制当局によるワクチンのロットリリース(我が国でいう国家検定)に際し、製造記録
の確認を重視することとしたことを踏まえ、日本の国家検定制度では2012年から、従来の実地試験
に加え、製造記録及び試験記録に基づく審査手法(SLP審査)を導入。
〇
SLP審査では、ロットごとに製造工程におけるパラメータや仕込量、品質確認のための出荷試験に
係る記録を確認することで、承認書に従って製造されたこと、及び、品質に問題がないことを確認。
※
SLP(Summary Lot Protocol、製造・試験記録等要約書。):ロットごとに製造工程の記録(製造記録)と品
質管理試験の記録(試験記録)を要約した文書
法令上の規定
○医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則(抄)
(医薬品の検定の申請及び検定機関)
第百九十七条
2 前項の申請書には、次の各号に掲げる検定の申請の区分に応じ、当該各号に定める書類を添えなければならない。
一 厚生労働大臣が指定する医薬品※(以下「指定製剤」という。)の検定の申請(当該指定製剤の検定が二以上
の製造段階について行われるべき場合にあつては、最終段階の検定の申請に限る。) 次のイ及びロに掲げる書
類
イ 申請に係る同一の製造番号又は製造記号の医薬品について作成した製品の製造及び試験の記録等を要約した
書類(以下「製造・試験記録等要約書」という。)
※令和6年1月時点、国家検定の対象となる全ての品目をSLP審査の対象として指定
4
〇
WHOが、規制当局によるワクチンのロットリリース(我が国でいう国家検定)に際し、製造記録
の確認を重視することとしたことを踏まえ、日本の国家検定制度では2012年から、従来の実地試験
に加え、製造記録及び試験記録に基づく審査手法(SLP審査)を導入。
〇
SLP審査では、ロットごとに製造工程におけるパラメータや仕込量、品質確認のための出荷試験に
係る記録を確認することで、承認書に従って製造されたこと、及び、品質に問題がないことを確認。
※
SLP(Summary Lot Protocol、製造・試験記録等要約書。):ロットごとに製造工程の記録(製造記録)と品
質管理試験の記録(試験記録)を要約した文書
法令上の規定
○医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則(抄)
(医薬品の検定の申請及び検定機関)
第百九十七条
2 前項の申請書には、次の各号に掲げる検定の申請の区分に応じ、当該各号に定める書類を添えなければならない。
一 厚生労働大臣が指定する医薬品※(以下「指定製剤」という。)の検定の申請(当該指定製剤の検定が二以上
の製造段階について行われるべき場合にあつては、最終段階の検定の申請に限る。) 次のイ及びロに掲げる書
類
イ 申請に係る同一の製造番号又は製造記号の医薬品について作成した製品の製造及び試験の記録等を要約した
書類(以下「製造・試験記録等要約書」という。)
※令和6年1月時点、国家検定の対象となる全ての品目をSLP審査の対象として指定
4