よむ、つかう、まなぶ。
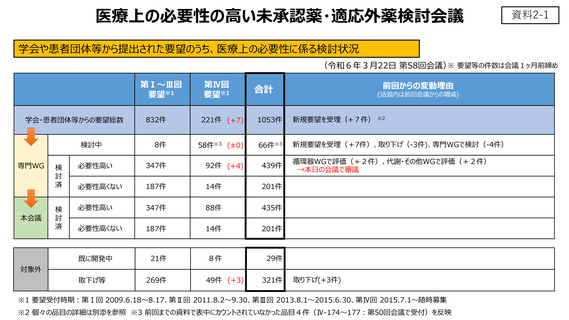
資料2-1 要望の医療上の必要性に係る検討状況等について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
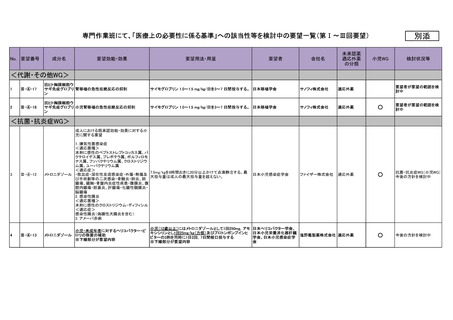
No.
要望番号
15
Ⅳ-177
16
Ⅳ-191
成分名
要望効能・効果
要望用法・用量
要望者
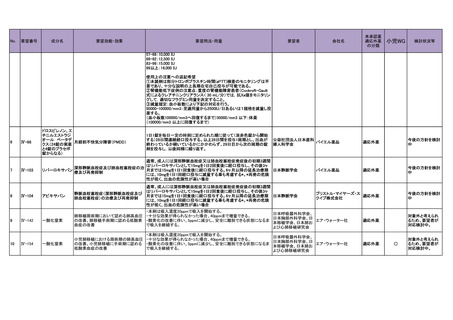
①通常、成人にはFDGスキャン注® 1バイアル(検定日時において185
MBq)を静脈内に投与し撮像する。投与量(放射能)は、年齢、体重によ
不明熱の原因部位の可視化(38℃以上
日本核医学会、日本臨
り適宜増減するが、最小74 MBq、最大370 MBqまでとする。
フルデオキシグ の発熱が3週間以上続き、一連の診療で
床検査医学会、日本感
②通常、成人にはフルデオキシグルコース(18F)静注「FRI」 1バイアル
ルコース(18F)
も発熱の原因部位が不明な場合に利
染症学会、日本リウマ
(検定日時において185 MBq)を静脈内に投与し撮像する。投与量(放射
用)
チ学会
能)は、年齢、体重により適宜増減するが、最小74 MBq、最大370 MBq
までとする。
〈多発血管炎性肉芽腫症、顕微鏡的多発血管炎、慢性特発性血小板減
○ 後天性血栓性血小板減少性紫斑病
少性紫斑病、後天性血栓性血小板減少性紫斑病、全身性強皮症〉
通常、成人には、リツキシマブ(遺伝子組換え)として1回量375mg/m2を1
※リツキシマブ(遺伝子組換え)の効能
週間間隔で4回点滴静注する。
又は効果として、既に後天性血栓性血小
リツキシマブ(遺
一般社団法人 日本血
板減少性紫斑病に対する承認が得られ
伝子組換え)
〈効能共通〉
液学会
ているが、効能又は効果に関連する注
本剤は用時生理食塩液又は5%ブドウ糖注射液にて1~4mg/mLに希釈調
意において再発又は難治の場合に使用
製し使用する。
が制限されていることから、当該使用上
の注意の改訂を希望する。
会社名
未承認薬
適応外薬
の分類
小児WG
検討状況等
①日本メジフィジックス株
式会社
適応外薬
②PDRファーマ株式会社
要望書確認中
全薬工業株式会社
要望書確認中
適応外薬
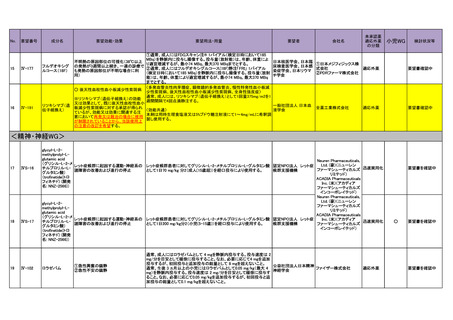
<精神・神経WG>
17
ⅣS-16
18
ⅣS-17
glycyl-L-2methylprolyl-Lglutamic acid
Neuren Pharmaceuticals,
(グリシル-L-2-メ
Ltd. (豪)(ニューレン
レット症候群に起因する運動・神経系の レット症候群患者に対してグリシル-L-2-メチルプロリル-L-グルタミン酸 認定NPO法人 レット症
チルプロリル-Lファーマシューティカルズ 迅速実用化
諸障害の改善および進行の停止
として1日70 mg/kg 分2(成人(15歳超))を経口投与により使用する。
候群支援機構
グルタミン酸)
リミテッド)
(trofinetide(トロ
ACADIA Pharmaceuticals
フィネチド) (開発
Inc. (米)(アカディア
名: NNZ-2566))
ファーマシューティカルズ
インコーポレイテッド)
Neuren Pharmaceuticals,
Ltd. (豪)(ニューレン
glycyl-L-2ファーマシューティカルズ
methylprolyl-Lリミテッド)
glutamic acid
ACADIA Pharmaceuticals
(グリシル-L-2-メ
レット症候群に起因する運動・神経系の レット症候群患者に対してグリシル-L-2-メチルプロリル-L-グルタミン酸 認定NPO法人 レット症
Inc. (米)(アカディア
チルプロリル-L迅速実用化
諸障害の改善および進行の停止
として1日200 mg/kg分2(小児(5-15歳))を経口投与により使用する。
候群支援機構
ファーマシューティカルズ
グルタミン酸)
インコーポレイテッド)
(trofinetide(トロ
要望書を確認中
○
要望書を確認中
フィネチド) (開発
名: NNZ-2566))
19
Ⅳ-102
ロラゼパム
①急性興奮の鎮静
②急性不安の鎮静
通常、成人にはロラゼパムとして 4 mgを静脈内投与する。投与速度は 2
mg/分を目安として緩徐に投与すること。なお、必要に応じて4 mgを追加
投与するが、初回投与と追加投与の総量として 8 mgを超えないこと。
公益社団法人日本精神
通常、生後 3 ヵ月以上の小児にはロラゼパムとして0.05 mg/kg(最大 4
ファイザー株式会社
神経学会
mg)を静脈内投与する。投与速度は 2 mg/分を目安として緩徐に投与す
ること。なお、必要に応じて0.05 mg/kgを追加投与するが、初回投与と追
加投与の総量として0.1 mg/kgを超えないこと。
適応外薬
要望書を確認中
11 / 213
要望番号
15
Ⅳ-177
16
Ⅳ-191
成分名
要望効能・効果
要望用法・用量
要望者
①通常、成人にはFDGスキャン注® 1バイアル(検定日時において185
MBq)を静脈内に投与し撮像する。投与量(放射能)は、年齢、体重によ
不明熱の原因部位の可視化(38℃以上
日本核医学会、日本臨
り適宜増減するが、最小74 MBq、最大370 MBqまでとする。
フルデオキシグ の発熱が3週間以上続き、一連の診療で
床検査医学会、日本感
②通常、成人にはフルデオキシグルコース(18F)静注「FRI」 1バイアル
ルコース(18F)
も発熱の原因部位が不明な場合に利
染症学会、日本リウマ
(検定日時において185 MBq)を静脈内に投与し撮像する。投与量(放射
用)
チ学会
能)は、年齢、体重により適宜増減するが、最小74 MBq、最大370 MBq
までとする。
〈多発血管炎性肉芽腫症、顕微鏡的多発血管炎、慢性特発性血小板減
○ 後天性血栓性血小板減少性紫斑病
少性紫斑病、後天性血栓性血小板減少性紫斑病、全身性強皮症〉
通常、成人には、リツキシマブ(遺伝子組換え)として1回量375mg/m2を1
※リツキシマブ(遺伝子組換え)の効能
週間間隔で4回点滴静注する。
又は効果として、既に後天性血栓性血小
リツキシマブ(遺
一般社団法人 日本血
板減少性紫斑病に対する承認が得られ
伝子組換え)
〈効能共通〉
液学会
ているが、効能又は効果に関連する注
本剤は用時生理食塩液又は5%ブドウ糖注射液にて1~4mg/mLに希釈調
意において再発又は難治の場合に使用
製し使用する。
が制限されていることから、当該使用上
の注意の改訂を希望する。
会社名
未承認薬
適応外薬
の分類
小児WG
検討状況等
①日本メジフィジックス株
式会社
適応外薬
②PDRファーマ株式会社
要望書確認中
全薬工業株式会社
要望書確認中
適応外薬
<精神・神経WG>
17
ⅣS-16
18
ⅣS-17
glycyl-L-2methylprolyl-Lglutamic acid
Neuren Pharmaceuticals,
(グリシル-L-2-メ
Ltd. (豪)(ニューレン
レット症候群に起因する運動・神経系の レット症候群患者に対してグリシル-L-2-メチルプロリル-L-グルタミン酸 認定NPO法人 レット症
チルプロリル-Lファーマシューティカルズ 迅速実用化
諸障害の改善および進行の停止
として1日70 mg/kg 分2(成人(15歳超))を経口投与により使用する。
候群支援機構
グルタミン酸)
リミテッド)
(trofinetide(トロ
ACADIA Pharmaceuticals
フィネチド) (開発
Inc. (米)(アカディア
名: NNZ-2566))
ファーマシューティカルズ
インコーポレイテッド)
Neuren Pharmaceuticals,
Ltd. (豪)(ニューレン
glycyl-L-2ファーマシューティカルズ
methylprolyl-Lリミテッド)
glutamic acid
ACADIA Pharmaceuticals
(グリシル-L-2-メ
レット症候群に起因する運動・神経系の レット症候群患者に対してグリシル-L-2-メチルプロリル-L-グルタミン酸 認定NPO法人 レット症
Inc. (米)(アカディア
チルプロリル-L迅速実用化
諸障害の改善および進行の停止
として1日200 mg/kg分2(小児(5-15歳))を経口投与により使用する。
候群支援機構
ファーマシューティカルズ
グルタミン酸)
インコーポレイテッド)
(trofinetide(トロ
要望書を確認中
○
要望書を確認中
フィネチド) (開発
名: NNZ-2566))
19
Ⅳ-102
ロラゼパム
①急性興奮の鎮静
②急性不安の鎮静
通常、成人にはロラゼパムとして 4 mgを静脈内投与する。投与速度は 2
mg/分を目安として緩徐に投与すること。なお、必要に応じて4 mgを追加
投与するが、初回投与と追加投与の総量として 8 mgを超えないこと。
公益社団法人日本精神
通常、生後 3 ヵ月以上の小児にはロラゼパムとして0.05 mg/kg(最大 4
ファイザー株式会社
神経学会
mg)を静脈内投与する。投与速度は 2 mg/分を目安として緩徐に投与す
ること。なお、必要に応じて0.05 mg/kgを追加投与するが、初回投与と追
加投与の総量として0.1 mg/kgを超えないこと。
適応外薬
要望書を確認中
11 / 213