よむ、つかう、まなぶ。
【資料1】日本製薬団体連合会提出資料.pdf (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40241.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第2回 5/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
医薬品産業界における課題感の整理
Key
word
必要な医薬品のアクセスの向上
安定供給
現 状
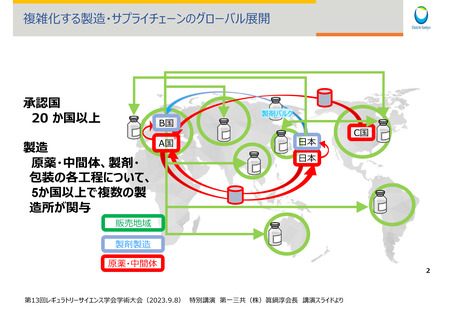
グローバル化の加速
ドラッグラグ・ロスの再燃
品質事案の頻発
課 題
予見可能性・効率化・国際整合性の高い
合理的な制度構築
・ガバナンス強化と自己責任の拡充
・サプライチェーンの国際整合性の整備
対応案
・迅速な薬事承認・変更管理を可能とする承認書の在り方(中等度の迅速変更)
・日本からの輸出に着目した規制整備
・MRA/MOUの拡大
・PIC/S GMPへの適応 (基準確認証制度の利用拡大)
・局方三極調和の推進
・国際共同治験(国内データの必要性)
・希少疾病用医薬品(早期指定)
・小児医薬品の開発計画の策定
・RMPの法的位置づけの整理
FPMAJ
・PACMP制度の拡充等
・製造管理者の要件の国際整合性
・製造所のガバナンス強化
Key
word
必要な医薬品のアクセスの向上
安定供給
現 状
グローバル化の加速
ドラッグラグ・ロスの再燃
品質事案の頻発
課 題
予見可能性・効率化・国際整合性の高い
合理的な制度構築
・ガバナンス強化と自己責任の拡充
・サプライチェーンの国際整合性の整備
対応案
・迅速な薬事承認・変更管理を可能とする承認書の在り方(中等度の迅速変更)
・日本からの輸出に着目した規制整備
・MRA/MOUの拡大
・PIC/S GMPへの適応 (基準確認証制度の利用拡大)
・局方三極調和の推進
・国際共同治験(国内データの必要性)
・希少疾病用医薬品(早期指定)
・小児医薬品の開発計画の策定
・RMPの法的位置づけの整理
FPMAJ
・PACMP制度の拡充等
・製造管理者の要件の国際整合性
・製造所のガバナンス強化