よむ、つかう、まなぶ。
資料4 新たに定期接種に位置づけられるワクチンに係る副反応疑い報告基準について[1.2MB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
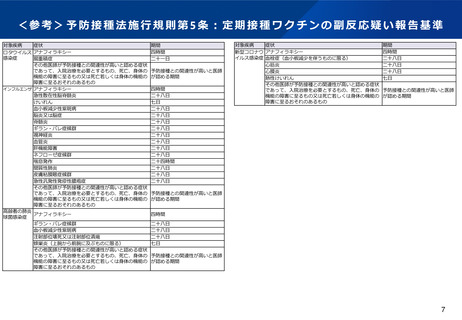
定期接種ワクチンにおける副反応疑い報告
制度の趣旨
副反応疑い報告制度は、予防接種後に生じる種々の身体的反応や副反応等について情報を収集し、ワクチンの安
全性について管理・検討を行うことで、広く国民に情報を提供すること及び今後の予防接種行政の推進に資する
ことを目的としている。
報告の義務:予防接種法第12条
病院若しくは診療所の開設者又は医師は、定期の予防接種等を受けた者が、当該定期の予防接種等を受けたこと
によるものと疑われる症状として厚生労働省令で定めるものを呈していることを知ったときは、その旨を厚生労
働省令で定めるところにより厚生労働大臣に報告しなければならない。
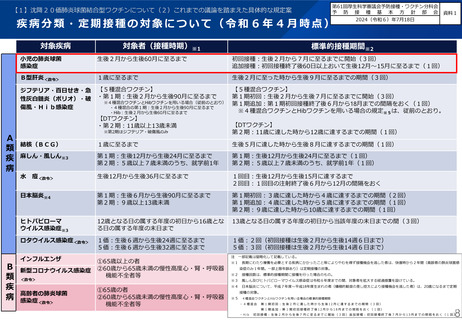
※「定期の予防接種等」は定期の予防接種又は臨時の予防接種を指す
報告の要件:予防接種法施行規則第5条
• 病院若しくは診療所の開設者又は医師が予防接種法施行規則第5条に規定する症状を診断した場合
• その他医師が予防接種との関連性が高いと認める症状であって、入院治療を必要とするもの、死亡、身体の機
能の障害に至るもの又は死亡若しくは身体の機能の障害に至るおそれのあるもの
3
制度の趣旨
副反応疑い報告制度は、予防接種後に生じる種々の身体的反応や副反応等について情報を収集し、ワクチンの安
全性について管理・検討を行うことで、広く国民に情報を提供すること及び今後の予防接種行政の推進に資する
ことを目的としている。
報告の義務:予防接種法第12条
病院若しくは診療所の開設者又は医師は、定期の予防接種等を受けた者が、当該定期の予防接種等を受けたこと
によるものと疑われる症状として厚生労働省令で定めるものを呈していることを知ったときは、その旨を厚生労
働省令で定めるところにより厚生労働大臣に報告しなければならない。
※「定期の予防接種等」は定期の予防接種又は臨時の予防接種を指す
報告の要件:予防接種法施行規則第5条
• 病院若しくは診療所の開設者又は医師が予防接種法施行規則第5条に規定する症状を診断した場合
• その他医師が予防接種との関連性が高いと認める症状であって、入院治療を必要とするもの、死亡、身体の機
能の障害に至るもの又は死亡若しくは身体の機能の障害に至るおそれのあるもの
3