よむ、つかう、まなぶ。
資料4 新たに定期接種に位置づけられるワクチンに係る副反応疑い報告基準について[1.2MB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
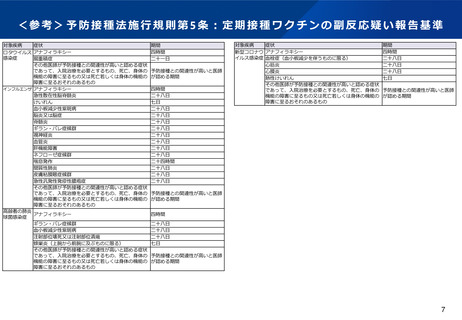
<参考>副反応疑い報告制度における報告
〇
予防接種後に生じた事象に関する情報を適切に収集し、評価を行うため、ワクチンに関する情報、接種時の状況、
発生した症状の概要及び転帰等について、報告するよう定めている。
報告対象
予防接種法・医薬品医療機器等法において、副反応を疑う場合の報告基準が定
められている。
予防接種法に基づく報告の対象
予防接種を受けたことによるものと疑われる症状のうち、
⚫ 予防接種ごとに、副反応として起こりうる典型的な症状(対象疾病・症状・
接種後の期間を国が規定)
⚫ 医師が予防接種との関連性が高いと認める症状であって、入院治療を要する
ものや、死亡・障害に至るおそれのあるもの
報告事項
○予防接種法上の定期接種・任意接種の別:
○患者情報 :氏名又はイニシャル、性別、接種時年齢、住所、生年月日
○報告者情報:氏名、医療機関名、電話番号、住所
○接種場所 :医療機関名、住所
○ワクチン情報:ワクチンの種類、ロット番号、製造販売業者、接種回数
○接種の状況:接種日、出生体重、接種前の体温、家族歴、予診票での留意点
○症状の概要:症状、発生日時、本剤との因果関係、他要因の可能性の有無、
概要(症状・徴候・臨床経過・診断・検査等)
○症状の程度:1重い(1.死亡、2.障害、3.死亡につながるおそれ、4.障害に
つながるおそれ、5.入院、6.上記1~5に準じて重い、7.
後世代における先天性の疾病又は異常)
2重くない
○症状の転帰:回復、軽快、未回復、後遺症、死亡、不明
○報告者意見
○報告回数
5
〇
予防接種後に生じた事象に関する情報を適切に収集し、評価を行うため、ワクチンに関する情報、接種時の状況、
発生した症状の概要及び転帰等について、報告するよう定めている。
報告対象
予防接種法・医薬品医療機器等法において、副反応を疑う場合の報告基準が定
められている。
予防接種法に基づく報告の対象
予防接種を受けたことによるものと疑われる症状のうち、
⚫ 予防接種ごとに、副反応として起こりうる典型的な症状(対象疾病・症状・
接種後の期間を国が規定)
⚫ 医師が予防接種との関連性が高いと認める症状であって、入院治療を要する
ものや、死亡・障害に至るおそれのあるもの
報告事項
○予防接種法上の定期接種・任意接種の別:
○患者情報 :氏名又はイニシャル、性別、接種時年齢、住所、生年月日
○報告者情報:氏名、医療機関名、電話番号、住所
○接種場所 :医療機関名、住所
○ワクチン情報:ワクチンの種類、ロット番号、製造販売業者、接種回数
○接種の状況:接種日、出生体重、接種前の体温、家族歴、予診票での留意点
○症状の概要:症状、発生日時、本剤との因果関係、他要因の可能性の有無、
概要(症状・徴候・臨床経過・診断・検査等)
○症状の程度:1重い(1.死亡、2.障害、3.死亡につながるおそれ、4.障害に
つながるおそれ、5.入院、6.上記1~5に準じて重い、7.
後世代における先天性の疾病又は異常)
2重くない
○症状の転帰:回復、軽快、未回復、後遺症、死亡、不明
○報告者意見
○報告回数
5