よむ、つかう、まなぶ。
薬-1日本製薬工業協会 米国研究製薬工業協会 欧州製薬団体連合会 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46579.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第230回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
Ⅰ 制度改革を反映させた社内検討体制・プロセスの見直し-1-
★はP3に記載した事例
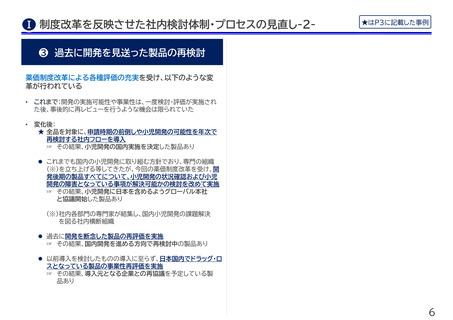
❶ 早期上市に向けたルール・体制整備
❷ 小児開発の積極的検討のルール化
迅速導入加算の導入(それに伴う新薬創出等加算の適用含)などを
受け、以下のような変革が行われている
小児用医薬品に対する評価の充実を受け、以下のような変革
が行われている
★
•
これまで:社内の開発会議体において、小児開発までは必ずしも検
討されておらず、個別製品で小児開発の可能性がありそうなもの
のみが検討されている状況であった
•
変化後:
★ 開発検討においては、成人と小児の同時開発を検討すること
をデフォルトとしてルール化
欧米から6か月以内のタイムライン内での開発検討を標準化
• これまで:各製品において海外との同時期の国内申請・承認の検討
は個々にされていたが、欧米から6か月以内というタイミングまで
は必ずしも意識されていなかった
•
変化後:優先審査の対象となることが見込まれる製品を中心に、欧
米から6か月以内の国内申請・承認を目指して開発計画を検討する
ことを標準化。この方針に沿って、個別製品の開発検討を進めてい
く
当初計画の申請タイムライン厳守の徹底
• これまで:これまでも国内での早期上市を目指してはいたものの、
早期に国内開発を進めることが困難と考えられる事情あるような
場合には、開発の実現可能性を優先し、申請までのタイムラインが
後倒しされることがあった
•
変化後:迅速導入加算の導入とその適用のインパクトが社内で広く
浸透した結果、ある製品では当初のタイムライン内での開発を厳守
するよう社内で意思決定がされた。他の製品も、迅速導入加算適用
を目指すことをデフォルトとして検討中
開発検討の際は、小児を対象とすることも積極的に検討する
ことを社内の標準ルールとして設定。併せて、小児開発におい
て検討すべき事項の手順化を実施。
年次で行う各パイプラインの開発計画のアセスメントにおいて、
小児開発のニーズや可能性を再度確認することをルール化
臨床試験実施の際は国内小児患者の組入れを併せて行うよう、
日本法人からグローバルに申し入れ (全領域)
(☞ その結果、第3相国際共同治験に日本人小児患者の組入
れを決定した製品あり)
5
★はP3に記載した事例
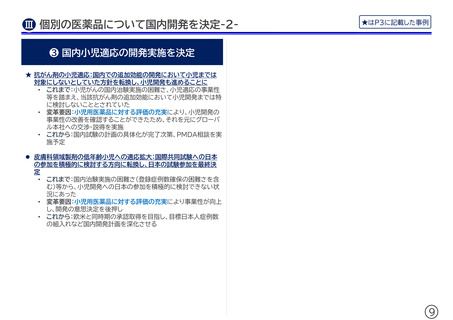
❶ 早期上市に向けたルール・体制整備
❷ 小児開発の積極的検討のルール化
迅速導入加算の導入(それに伴う新薬創出等加算の適用含)などを
受け、以下のような変革が行われている
小児用医薬品に対する評価の充実を受け、以下のような変革
が行われている
★
•
これまで:社内の開発会議体において、小児開発までは必ずしも検
討されておらず、個別製品で小児開発の可能性がありそうなもの
のみが検討されている状況であった
•
変化後:
★ 開発検討においては、成人と小児の同時開発を検討すること
をデフォルトとしてルール化
欧米から6か月以内のタイムライン内での開発検討を標準化
• これまで:各製品において海外との同時期の国内申請・承認の検討
は個々にされていたが、欧米から6か月以内というタイミングまで
は必ずしも意識されていなかった
•
変化後:優先審査の対象となることが見込まれる製品を中心に、欧
米から6か月以内の国内申請・承認を目指して開発計画を検討する
ことを標準化。この方針に沿って、個別製品の開発検討を進めてい
く
当初計画の申請タイムライン厳守の徹底
• これまで:これまでも国内での早期上市を目指してはいたものの、
早期に国内開発を進めることが困難と考えられる事情あるような
場合には、開発の実現可能性を優先し、申請までのタイムラインが
後倒しされることがあった
•
変化後:迅速導入加算の導入とその適用のインパクトが社内で広く
浸透した結果、ある製品では当初のタイムライン内での開発を厳守
するよう社内で意思決定がされた。他の製品も、迅速導入加算適用
を目指すことをデフォルトとして検討中
開発検討の際は、小児を対象とすることも積極的に検討する
ことを社内の標準ルールとして設定。併せて、小児開発におい
て検討すべき事項の手順化を実施。
年次で行う各パイプラインの開発計画のアセスメントにおいて、
小児開発のニーズや可能性を再度確認することをルール化
臨床試験実施の際は国内小児患者の組入れを併せて行うよう、
日本法人からグローバルに申し入れ (全領域)
(☞ その結果、第3相国際共同治験に日本人小児患者の組入
れを決定した製品あり)
5