よむ、つかう、まなぶ。
薬-1日本製薬工業協会 米国研究製薬工業協会 欧州製薬団体連合会 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46579.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第230回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
Ⅲ 個別の医薬品について国内開発を決定-2-
★はP3に記載した事例
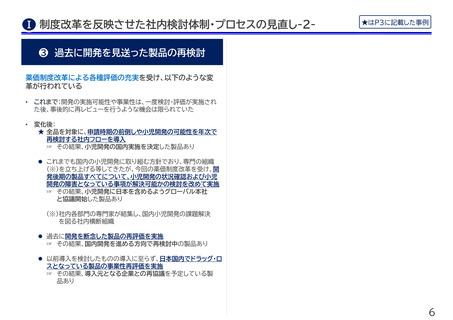
❸ 国内小児適応の開発実施を決定
★ 抗がん剤の小児適応:国内での追加効能の開発において小児までは
対象にしないとしていた方針を転換し、小児開発も進めることに
• これまで:小児がんの国内治験実施の困難さ、小児適応の事業性
等を踏まえ、当該抗がん剤の追加効能において小児開発までは特
に検討しないこととされていた
• 変革要因:小児用医薬品に対する評価の充実により、小児開発の
事業性の改善を確認することができたため、それを元にグローバ
ル本社への交渉・説得を実施
• これから:国内試験の計画の具体化が完了次第、PMDA相談を実
施予定
皮膚科領域製剤の低年齢小児への適応拡大:国際共同試験への日本
の参加を積極的に検討する方向に転換し、日本の試験参加を最終決
定
• これまで:国内治験実施の困難さ(登録症例数確保の困難さを含
む)等から、小児開発への日本の参加を積極的に検討できない状
況にあった
• 変革要因:小児用医薬品に対する評価の充実により事業性が向上
し、開発の意思決定を後押し
• これから:欧米と同時期の承認取得を目指し、目標日本人症例数
の組入れなど国内開発計画を深化させる
9
★はP3に記載した事例
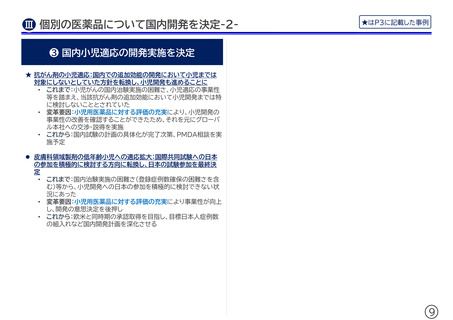
❸ 国内小児適応の開発実施を決定
★ 抗がん剤の小児適応:国内での追加効能の開発において小児までは
対象にしないとしていた方針を転換し、小児開発も進めることに
• これまで:小児がんの国内治験実施の困難さ、小児適応の事業性
等を踏まえ、当該抗がん剤の追加効能において小児開発までは特
に検討しないこととされていた
• 変革要因:小児用医薬品に対する評価の充実により、小児開発の
事業性の改善を確認することができたため、それを元にグローバ
ル本社への交渉・説得を実施
• これから:国内試験の計画の具体化が完了次第、PMDA相談を実
施予定
皮膚科領域製剤の低年齢小児への適応拡大:国際共同試験への日本
の参加を積極的に検討する方向に転換し、日本の試験参加を最終決
定
• これまで:国内治験実施の困難さ(登録症例数確保の困難さを含
む)等から、小児開発への日本の参加を積極的に検討できない状
況にあった
• 変革要因:小児用医薬品に対する評価の充実により事業性が向上
し、開発の意思決定を後押し
• これから:欧米と同時期の承認取得を目指し、目標日本人症例数
の組入れなど国内開発計画を深化させる
9