よむ、つかう、まなぶ。
薬-1日本製薬工業協会 米国研究製薬工業協会 欧州製薬団体連合会 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46579.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第230回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
Ⅱ 個別の医薬品について開発計画を再検討
★はP3に記載した事例
❶ 申請・上市時期の前倒しの検討
❷ 小児開発の検討
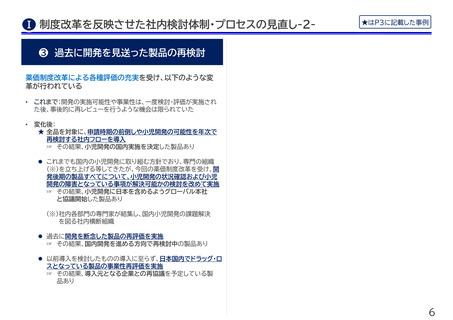
★ 希少疾病治療薬の国内申請・上市時期の前倒し
• これまで:グローバルの予算・人的リソースの制約から、欧米での
申請を優先し、一定期間経過後に日本での申請を行うことを予定
していた
• 変革要因:迅速導入加算の導入を、グローバル本社が非常に前向
きに受け止め
• これから:国内申請時期の前倒しを目指して、日本に対して優先
的にリソース配分をすること等をグローバル本社と共に検討中
★ 希少疾病・指定難病治療薬の小児適応開発
• これまで:主に成人に多い疾患で、小児のケースは非常に稀であ
ることから、小児適応の開発までは検討されてこなかった
• 変革要因:小児用医薬品に対する評価の充実を受け、社内パイプ
ラインにおける小児適応の取得可能性と事業性の評価を実施。そ
の結果、本製品では小児開発の可能性があることを確認。
• これから:グローバルの開発の委員会において、日本での本件開
発に関する審議を実施予定
抗がん剤の国内申請・上市時期の前倒し
• これまで:優先審査の対象とはなり得ても、先駆的医薬品や希少
疾病医薬品の対象とならない製品は、薬価上の直接のインセン
ティブが存在しないことから、国内開発検討の優先順位が低くな
る傾向にあった
• 変革要因:迅速導入加算の導入により、優先審査制度を活用する
意欲が向上。欧米から6か月以内の申請・承認を志向するように
なった。
• これから:優先審査・迅速導入加算の適用実現に向けて、申請まで
のスケジュールの短縮を実現するための計画策定を進めている
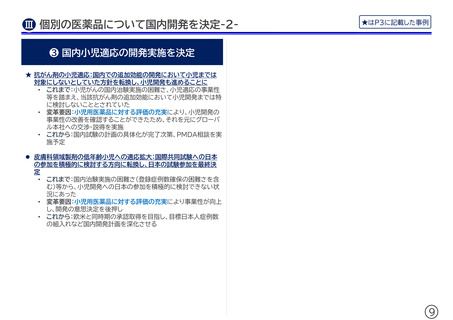
希少疾病治療薬の小児適応開発
• これまで:希少疾病は国内小児患者数が限られ、治験への組入れ
ができないリスクや事業性の課題があることから、グローバルで
の小児開発に日本は積極的に参加しないことが一般的であった
• 変革要因:小児用医薬品に対する評価の充実によって本製品の小
児適応の事業性改善が見込まれるようになったため、グローバル
の開発への日本の参加を日本法人の経営会議で改めて検討・判
断した
• これから:事業性改善や治験の実現可能性に関する日本法人の評
価結果を踏まえ、グローバル本社側での事業性評価を進めていく
国内申請・上市時期の前倒し(対象疾患非開示)
• これまで:国内第1相試験完了を待ってからの国際共同治験参加
であった。また、日本の薬価に対するグローバル本社の期待値が
低く、日本での申請が欧米やその他の国・地域より遅いタイミング
となっていた。
• 変革要因:薬事制度改革により国内第1相完了を待たずに第3相
国際共同治験に参加できるようになったこと。迅速導入加算の導
入による薬価へのインパクトの期待。
• これから:日本が早期に国際共同治験に参加する開発計画の具体
化を進めており、年内にもグローバル本社にて日本での開発実施
を決定見込み
小児適応開発(対象疾患非開示)
• これまで:小児開発の事業性の乏しさから、導入候補品の検討に
おいて小児開発までは視野に入れていなかった
• 変革要因:小児用医薬品に対する評価の充実が、小児開発の検討
開始のきっかけに
• これから:小児も対象に含めた形で、導入交渉を進める予定
7
★はP3に記載した事例
❶ 申請・上市時期の前倒しの検討
❷ 小児開発の検討
★ 希少疾病治療薬の国内申請・上市時期の前倒し
• これまで:グローバルの予算・人的リソースの制約から、欧米での
申請を優先し、一定期間経過後に日本での申請を行うことを予定
していた
• 変革要因:迅速導入加算の導入を、グローバル本社が非常に前向
きに受け止め
• これから:国内申請時期の前倒しを目指して、日本に対して優先
的にリソース配分をすること等をグローバル本社と共に検討中
★ 希少疾病・指定難病治療薬の小児適応開発
• これまで:主に成人に多い疾患で、小児のケースは非常に稀であ
ることから、小児適応の開発までは検討されてこなかった
• 変革要因:小児用医薬品に対する評価の充実を受け、社内パイプ
ラインにおける小児適応の取得可能性と事業性の評価を実施。そ
の結果、本製品では小児開発の可能性があることを確認。
• これから:グローバルの開発の委員会において、日本での本件開
発に関する審議を実施予定
抗がん剤の国内申請・上市時期の前倒し
• これまで:優先審査の対象とはなり得ても、先駆的医薬品や希少
疾病医薬品の対象とならない製品は、薬価上の直接のインセン
ティブが存在しないことから、国内開発検討の優先順位が低くな
る傾向にあった
• 変革要因:迅速導入加算の導入により、優先審査制度を活用する
意欲が向上。欧米から6か月以内の申請・承認を志向するように
なった。
• これから:優先審査・迅速導入加算の適用実現に向けて、申請まで
のスケジュールの短縮を実現するための計画策定を進めている
希少疾病治療薬の小児適応開発
• これまで:希少疾病は国内小児患者数が限られ、治験への組入れ
ができないリスクや事業性の課題があることから、グローバルで
の小児開発に日本は積極的に参加しないことが一般的であった
• 変革要因:小児用医薬品に対する評価の充実によって本製品の小
児適応の事業性改善が見込まれるようになったため、グローバル
の開発への日本の参加を日本法人の経営会議で改めて検討・判
断した
• これから:事業性改善や治験の実現可能性に関する日本法人の評
価結果を踏まえ、グローバル本社側での事業性評価を進めていく
国内申請・上市時期の前倒し(対象疾患非開示)
• これまで:国内第1相試験完了を待ってからの国際共同治験参加
であった。また、日本の薬価に対するグローバル本社の期待値が
低く、日本での申請が欧米やその他の国・地域より遅いタイミング
となっていた。
• 変革要因:薬事制度改革により国内第1相完了を待たずに第3相
国際共同治験に参加できるようになったこと。迅速導入加算の導
入による薬価へのインパクトの期待。
• これから:日本が早期に国際共同治験に参加する開発計画の具体
化を進めており、年内にもグローバル本社にて日本での開発実施
を決定見込み
小児適応開発(対象疾患非開示)
• これまで:小児開発の事業性の乏しさから、導入候補品の検討に
おいて小児開発までは視野に入れていなかった
• 変革要因:小児用医薬品に対する評価の充実が、小児開発の検討
開始のきっかけに
• これから:小児も対象に含めた形で、導入交渉を進める予定
7