よむ、つかう、まなぶ。
薬-1日本製薬工業協会 米国研究製薬工業協会 欧州製薬団体連合会 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_46579.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第230回 12/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
Ⅰ 制度改革を反映させた社内検討体制・プロセスの見直し-2-
★はP3に記載した事例
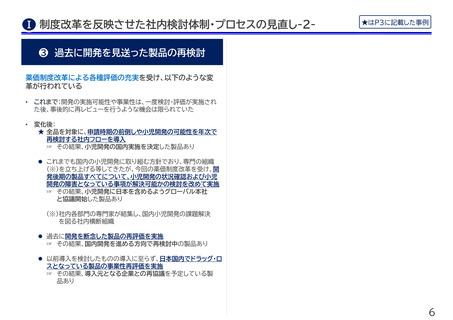
❸ 過去に開発を見送った製品の再検討
薬価制度改革による各種評価の充実を受け、以下のような変
革が行われている
•
これまで:開発の実施可能性や事業性は、一度検討・評価が実施され
た後、事後的に再レビューを行うような機会は限られていた
•
変化後:
★ 全品を対象に、申請時期の前倒しや小児開発の可能性を年次で
再検討する社内フローを導入
☞ その結果、小児開発の国内実施を決定した製品あり
これまでも国内の小児開発に取り組む方針でおり、専門の組織
(※)を立ち上げる等してきたが、今回の薬価制度改革を受け、開
発後期の製品すべてについて、小児開発の状況確認および小児
開発の障害となっている事項が解決可能かの検討を改めて実施
☞ その結果、小児開発に日本を含めるようグローバル本社
と協議開始した製品あり
(※)社内各部門の専門家が結集し、国内小児開発の課題解決
を図る社内横断組織
過去に開発を断念した製品の再評価を実施
☞ その結果、国内開発を進める方向で再検討中の製品あり
以前導入を検討したものの導入に至らず、日本国内でドラッグ・ロ
スとなっている製品の事業性再評価を実施
☞ その結果、導入元となる企業との再協議を予定している製
品あり
6
★はP3に記載した事例
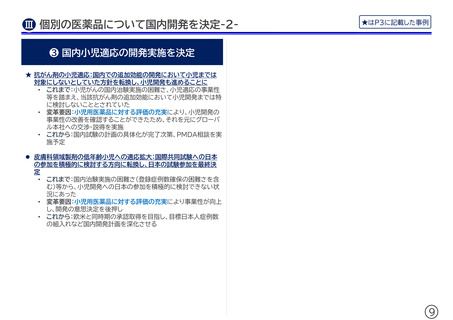
❸ 過去に開発を見送った製品の再検討
薬価制度改革による各種評価の充実を受け、以下のような変
革が行われている
•
これまで:開発の実施可能性や事業性は、一度検討・評価が実施され
た後、事後的に再レビューを行うような機会は限られていた
•
変化後:
★ 全品を対象に、申請時期の前倒しや小児開発の可能性を年次で
再検討する社内フローを導入
☞ その結果、小児開発の国内実施を決定した製品あり
これまでも国内の小児開発に取り組む方針でおり、専門の組織
(※)を立ち上げる等してきたが、今回の薬価制度改革を受け、開
発後期の製品すべてについて、小児開発の状況確認および小児
開発の障害となっている事項が解決可能かの検討を改めて実施
☞ その結果、小児開発に日本を含めるようグローバル本社
と協議開始した製品あり
(※)社内各部門の専門家が結集し、国内小児開発の課題解決
を図る社内横断組織
過去に開発を断念した製品の再評価を実施
☞ その結果、国内開発を進める方向で再検討中の製品あり
以前導入を検討したものの導入に至らず、日本国内でドラッグ・ロ
スとなっている製品の事業性再評価を実施
☞ その結果、導入元となる企業との再協議を予定している製
品あり
6