よむ、つかう、まなぶ。
資料1-2:日本医療機器産業連合会 谷岡委員 提出資料 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_49984.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第39回 1/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
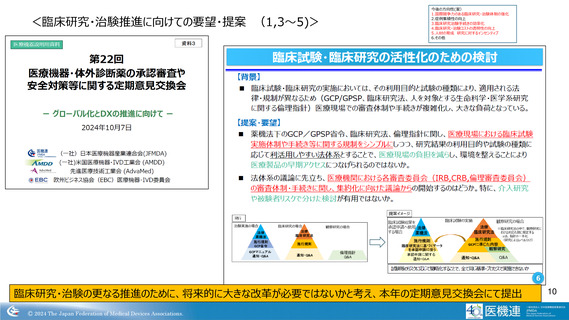
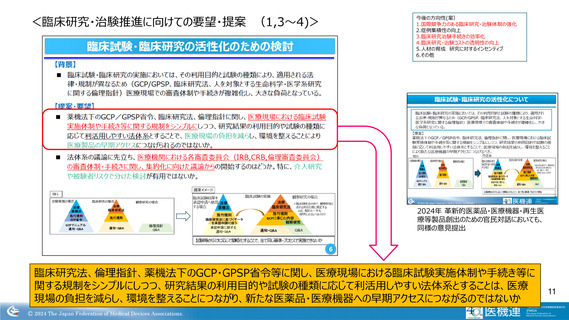
<臨床研究・治験推進に向けての要望・提案 (1,3~4)>
2024年 革新的医薬品・医療機器・再生医
療等製品創出のための官民対話においても、
同様の意見提出
臨床研究法、倫理指針、薬機法下のGCP・GPSP省令等に関し、医療現場における臨床試験実施体制や手続き等に
関する規制をシンプルにしつつ、研究結果の利用目的や試験の種類に応じて利活用しやすい法体系とすることは、医療
現場の負担を減らし、環境を整えることにつながり、新たな医薬品・医療機器への早期アクセスにつながるのではないか
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
11
2024年 革新的医薬品・医療機器・再生医
療等製品創出のための官民対話においても、
同様の意見提出
臨床研究法、倫理指針、薬機法下のGCP・GPSP省令等に関し、医療現場における臨床試験実施体制や手続き等に
関する規制をシンプルにしつつ、研究結果の利用目的や試験の種類に応じて利活用しやすい法体系とすることは、医療
現場の負担を減らし、環境を整えることにつながり、新たな医薬品・医療機器への早期アクセスにつながるのではないか
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
11