よむ、つかう、まなぶ。
資料1-2:日本医療機器産業連合会 谷岡委員 提出資料 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_49984.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第39回 1/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
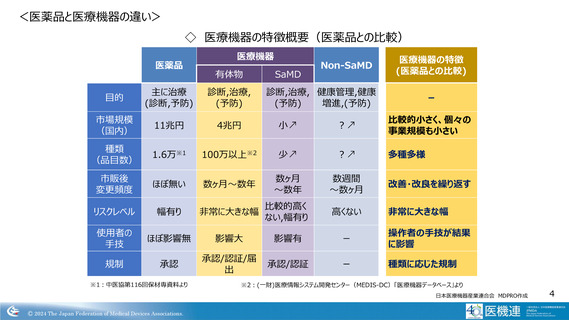
<医薬品と医療機器の違い>
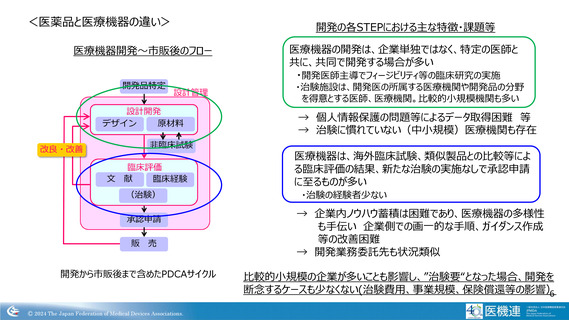
医療機器開発~市販後のフロー
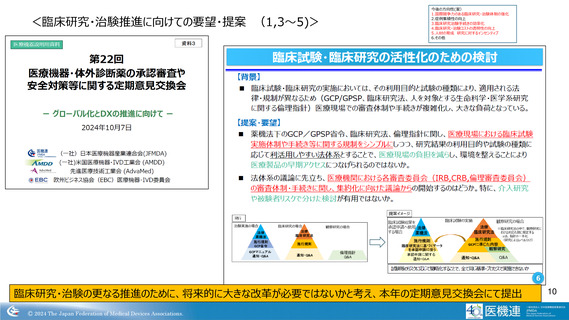
開発の各STEPにおける主な特徴・課題等
医療機器の開発は、企業単独ではなく、特定の医師と
共に、共同で開発する場合が多い
・開発医師主導でフィージビリティ等の臨床研究の実施
・治験施設は、開発医の所属する医療機関や開発品の分野
を得意とする医師、医療機関。比較的小規模機関も多い
→ 個人情報保護の問題等によるデータ取得困難 等
→ 治験に慣れていない(中小規模)医療機関も存在
医療機器は、海外臨床試験、類似製品との比較等によ
る臨床評価の結果、新たな治験の実施なしで承認申請
に至るものが多い
・治験の経験者少ない
→ 企業内ノウハウ蓄積は困難であり、医療機器の多様性
も手伝い 企業側での画一的な手順、ガイダンス作成
等の改善困難
→ 開発業務委託先も状況類似
開発から市販後まで含めたPDCAサイクル
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
比較的小規模の企業が多いことも影響し、”治験要“となった場合、開発を
断念するケースも少なくない(治験費用、事業規模、保険償還等の影響)
6
医療機器開発~市販後のフロー
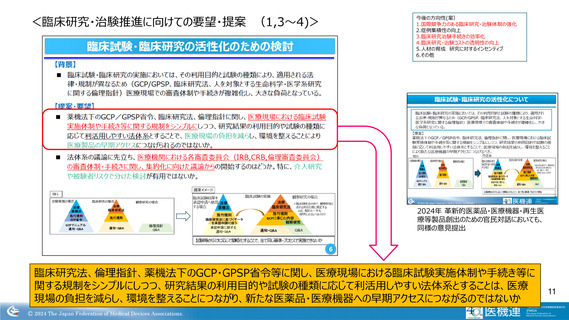
開発の各STEPにおける主な特徴・課題等
医療機器の開発は、企業単独ではなく、特定の医師と
共に、共同で開発する場合が多い
・開発医師主導でフィージビリティ等の臨床研究の実施
・治験施設は、開発医の所属する医療機関や開発品の分野
を得意とする医師、医療機関。比較的小規模機関も多い
→ 個人情報保護の問題等によるデータ取得困難 等
→ 治験に慣れていない(中小規模)医療機関も存在
医療機器は、海外臨床試験、類似製品との比較等によ
る臨床評価の結果、新たな治験の実施なしで承認申請
に至るものが多い
・治験の経験者少ない
→ 企業内ノウハウ蓄積は困難であり、医療機器の多様性
も手伝い 企業側での画一的な手順、ガイダンス作成
等の改善困難
→ 開発業務委託先も状況類似
開発から市販後まで含めたPDCAサイクル
Ⓒ 2024 The Japan Federation of Medical Devices Associations.
比較的小規模の企業が多いことも影響し、”治験要“となった場合、開発を
断念するケースも少なくない(治験費用、事業規模、保険償還等の影響)
6