よむ、つかう、まなぶ。
資料2:臨床研究中核病院の承認要件見直しについて (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_55079.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第41回 3/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
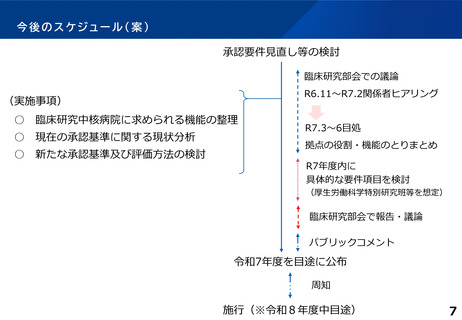
ヒアリングにおける主なご意見①
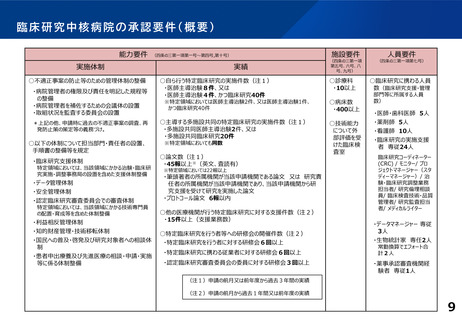
論点1:臨床研究中核病院の承認制度
○ 個々の臨床研究中核病院がもつ特長を活かした国際的な創薬・育薬加速化の取り組みを評価すべ
き。
○ 我が国の国際水準の臨床研究や医師主導治験の中心的役割を担う拠点として、人員に対し、専門
性と実績に相応しいインセンティブが用意されるべき。
○ 医療機器開発につながる臨床研究(feasibility study、FIH; first-in-human、観察研究等)の実
施、医療機器治験や臨床研究の支援(中央IRBなど倫理審査のリード役等)、臨床研究関連の教育
セミナーや講演会の実施を責務として評価すべき。
○ 数値要件達成に邁進をするとともに、すでに承認を受けている機関は数値要件を毎年維持するこ
とを第一に取り組み、それに疲弊している。本来の臨床研究中核病院としてのKPIは毎年ではなく、
数年単位で評価すべきではないか。特に、臨床研究法下の臨床試験の煩雑さが現場を疲弊させる
と共に、臨床研究全体の質の向上に役に立っていないと考える。また、これを達成することが臨
床研究中核病院の目的と化している。
○ 臨床試験におけるPPIの取組を支援している点を評価に加えることを検討してはどうか。
○ 多種多様な医療機器での施設特化は困難と思われるため、例えば、“医療機器開発”を宣言・標榜す
る形をとり、当該施設での開発推進、他施設の開発支援を行うことを求めてはどうか。
2
論点1:臨床研究中核病院の承認制度
○ 個々の臨床研究中核病院がもつ特長を活かした国際的な創薬・育薬加速化の取り組みを評価すべ
き。
○ 我が国の国際水準の臨床研究や医師主導治験の中心的役割を担う拠点として、人員に対し、専門
性と実績に相応しいインセンティブが用意されるべき。
○ 医療機器開発につながる臨床研究(feasibility study、FIH; first-in-human、観察研究等)の実
施、医療機器治験や臨床研究の支援(中央IRBなど倫理審査のリード役等)、臨床研究関連の教育
セミナーや講演会の実施を責務として評価すべき。
○ 数値要件達成に邁進をするとともに、すでに承認を受けている機関は数値要件を毎年維持するこ
とを第一に取り組み、それに疲弊している。本来の臨床研究中核病院としてのKPIは毎年ではなく、
数年単位で評価すべきではないか。特に、臨床研究法下の臨床試験の煩雑さが現場を疲弊させる
と共に、臨床研究全体の質の向上に役に立っていないと考える。また、これを達成することが臨
床研究中核病院の目的と化している。
○ 臨床試験におけるPPIの取組を支援している点を評価に加えることを検討してはどうか。
○ 多種多様な医療機器での施設特化は困難と思われるため、例えば、“医療機器開発”を宣言・標榜す
る形をとり、当該施設での開発推進、他施設の開発支援を行うことを求めてはどうか。
2